Крио-абляция при мерцательной аритмии
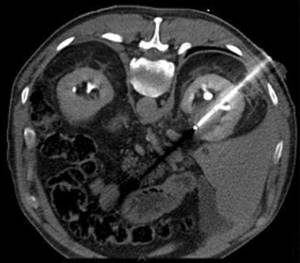
Одним из современных методов лечения фибрилляции предсердий (ФП) является криоабляция с использованием криобаллонного катетера. Как видно из названия, доставка холодового агента для заморозки ткани и прекращения неж елательных циркуляций электрических импульсов, способствующих возникновению и поддержанию ФП, осуществляется через раздуваемый баллон.
Криобаллонная абляция легочных вен – это безопасный, эффективный и простой метод для лечения ФП. Криобаллонная абляция подтвердила свою эффективность более чем у 100 000 пациентов в 800 клиниках по всему миру. Благодаря форме баллона, доступ к легочной вене (области нежелательных циркуляций электрических токов, поддерживающих ФП) быстр и эффективен.
Как и при любой медицинской процедуре, при катетерной абляции есть свои преимущества и риски.Как это работает С помощью холодового воздействия создается блок перехода нежелательных электрических импульсов с легочных вен (крупные кровеносные сосуды, которые приносят кровь от легких в левое предсердие) и их распространение по предсердиям (верхние камеры сердца).
Это обеспечивается процедурой, известной как изоляция легочных вен, направленная на абляцию ткани в месте соединения легочных вен с предсердием и прекращение распространения с них нежелательных электрических импульсов. Во время процедуры врач делает прокол в паховой области, через который вводит катетер, далее катетер проводится в правое предсердие сердца.
Затем хирург делает пункцию межпредсердной перегородки (стенки, которая разделяет правую и левую части сердца). Пункция позволяет обеспечить доступ в левое предсердие. Криобаллонный катетер вводится в левое предсердие. Врач раздувает баллон и продвигает его ко входу в легочную вену.
Цель – закрыть место впадения легочной вены полностью, что остановит поток крови между предсердием и веной (это называется окклюзией). Как только окклюзия подтверждена, врач вводит сжиженный холодовой агент в криобаллон. Испаряясь, холодовой агент забирает тепло из ткани сердца – там, где баллон контактирует с ней, в области впадения легочной вены.
В результате на ткани формируется рубец, и она не может больше проводить электрические токи, которые были причиной мерцательной аритмии.
http://mertsalka.net/krio-ablyatsiya-pri-mertsatelnoy-aritmii
Криоабляция сердца
Криоабляция сердца
Cardiac Catheter Cryoablation (Cryotherapy; Cryoablation)Криоабляция использует воздействие чрезвычайно низких температур для разрушения клеток. Криоабляция сердца используется для уничтожения патологических клеток сердца.
Причины проведения процедуры
Процедура проводится чтобы »отключить» клетки сердца, которые создают нарушение сердечного ритма (аритмия). После процедуры нормальный сердечный ритм должен быть восстановлен.
Возможные осложнения после криоабляции сердца
Осложнения встречаются редко, но никакая процедура не гарантирует отсутствие риска. Перед тем, как выполнить процедуру, нужно знать о возможных осложнениях, которые могут включать:
- Кровотечение;
- Инфекция;
- Боль в месте введения катетера;
- Сгустки крови;
- Травмы кровеносных сосудов и сердца;
- Аномальный сердечный ритм;
- Сердечный приступ;
- Прокол сердца.
Факторы, которые могут увеличить риск осложнений включают в себя:Уровень риска может быть связан с конкретным типом аритмии.
Как проводится криоабляция?
Подготовка к процедуре
Врач, скорее всего, выполнит следующие действия:
- Электрофизиологическое исследование (ЭФИ сердца), чтобы точно определить расположение аномальных ритмов;
- Попросит прекратить принимать лекарства, которые ранее использовались для лечения аритмии.
В преддверии процедуры:
- Не надо ничего есть или пить в течение восьми часов перед процедурой;
- Следуйте инструкциям врача.
Буде введен местный анестетик. Он обезболит область, где будет вставлен катетер. Вы также получите мягкое седативное через капельницу в руку. Это поможет вам расслабиться во время процедуры.
Описание процедуры
Специальный катетер для абляции будет вставлен в кровеносный сосуд в паху, верхней части бедра, руки или на запястье. Область введения катетера будет очищена и обезболена с помощью анестезии.
Катетер будет введен в артерию и подведен к кровеносным сосудам в сердце. Врач сможет увидеть катетер на экране специального рентгеновского аппарата.Врач находит источник аритмии. Это будет сделано путем определения места аритмии специальным наконечником катетера.
Как только проблемное место будет найдено, оно будет охлаждено с помощью кончика катетера. Если место источника аритмии найдено правильно, проблема исчезнет. Если место выбрано ошибочно, холодный конец катетера удаляется и ткань не будет иметь никаких повреждений.
Когда место возникновения аритмии определено правильно, конец катетера будет охлажден до -70°C. Это заморозит ткань сердца и устранит аритмию. Процедура поиска повторяется, пока не будут устранены все источники аритмии.
Сразу после процедуры
Вы будете перемещены в послеоперационную палату.
Персонал будет наблюдать за жизненными показателями в течение нескольких часов для обнаружения симптомов болезненности, проблем с сердечным ритмом, кровотечения из места введения катетера.
Необходимо лежать на спине в течение некоторого периода времени. На месте, где был вставлен катетер, может быть наложена повязка чтобы предотвратить кровотечение. Важно следовать указаниям медсестры и врача.
Сколько времени займет процедура?
3-6 часов (иногда больше).
Будет ли это больно?
Вы можете почувствовать некоторые незначительные неудобства во время введения катетера. Может также чувствоваться головокружение, учащенное сердцебиение, боли в груди в процессе замораживания.
Среднее время пребывания в больнице
Большинство пациентов должны остаться в больнице на ночь для дальнейшего наблюдения. Врач может продлить пребывание, если возникают осложнения.
Уход за пациентом после криоабляции сердца
Уход в больнице
- В месте введения катетера могут быть синяки и боль;
- Если катетер вводился в паховой области нужно некоторое время лежать в постели с выпрямленными ногами;
- Если катетер вводился в запястье или руку, оставаться в постели не нужно;
- Место введения катетера будет контролироваться на наличие признаков кровотечения, отека или воспаления;
- Будут контролироваться жизненные параметры.
Уход на дому
Когда вы возвращаетесь домой после процедуры, выполните следующие действия, чтобы обеспечить нормальное восстановление:
- Принимайте аспирин по назначению в течение 2-4 недель. Это поможет снизить риск образования тромбов в месте введения катетера;
- Можно вернуться к обычной деятельности, разрешается ходьба или подъем по ступенькам. Воздержитесь от тяжелых или физических нагрузок в течение 24 часов. В большинстве случаев вы сможете вернуться к нормальному уровню активности в течение нескольких дней;
- Своевременно нужно наносить визиты к врачу. Места введения катетера должны быть проверены на отсутствие осложнений.
У этой процедуры чрезвычайно высокая частота успеха и низкий риск развития осложнений. Однако:
- При наличии фибрилляции предсердий или желудочковой тахикардии, возможно, придется продолжать антиаритмическую терапию;
- После криоабляции АВ узла, вам потребуется кардиостимулятор.
Связь с врачом после криоабляции сердца
После возвращения домой нужно обратиться к врачу, если появились следующие симптомы:
- Признаки инфекции, включая лихорадку и озноб;
- Покраснение, отек, усиление боли, кровотечение, или выделения в месте установки катетера;
- Нога, в которую вводился катетер, мерзнет, становится белой или голубой, затекает или возникает покалывание;
- Кашель, одышка, боль в груди, или сильная тошнота или рвота;
- Дискомфорт в челюсти, груди, шее, руке, или верхней части спины;
- Головокружение и слабость.
http://medicalhandbook.ru/operations/3348-krioablyatsiya-serdtsa-krioablyatsiya.html
Операция криоабляция для лечения фибрилляции предсердий и левопредсердных тахиаритмий
Рис. 1 Криобаллон и Рис. 2 Катетер для радиочастотной абляции
Катетерное лечение фибрилляции предсердий началось в 1998 году, после публикации французских исследователей из группы Michel Haissaguerre о первом успешном опыте лечения пациента с триггером из структур легочной вены.За прошедшие годы большинство выполненных процедур проведены с использованием радиочастотной энергии.
Линейные радиочастотные воздействия формируются путем нанесения последовательных точечных воздействий. Основной целью процедуры является электрическая изоляция устьев легочных вен т.е. электрическое разобщение легочных вен от электрически активных тканей левого предсердия, а в конечном счете — всего сердца.
Момент электрической изоляции подтверждается с помощью циркулярного катетера, который собирает информацию во время проведения радиочастотного воздействия. С 2012 года в Северной Америке официально признано два способа электрической изоляции устьев легочных вен: точка по точке (point-by-point) и криобаллонная абляция.
С 2016 это нашло подтверждение в рекомендациях Европейского общества кардиологов (ESC), а в 2017 году и Всероссийского научного общества аритмологов (ВНОА).Охлаждение (криовоздействие) удаляет тепло из ткани, радиочастотное воздействие добавляет тепло ткани.
Противоположные по своей природе действия приводят к сходному результату – потере электропроводности тканью в месте воздействия. Радикально отличается и устройство катетера (рис.1 и 2)
Процедура выполнения радиочастоной абляции для лечения фибрилляции предсердий описана в разделе:
Эндокардиальное электрофизиологическое исследование, катетерная радиочастотная абляция левопредсердных тахиаритмий (фибрилляция предсердий)
Фибрилляция предсердий (мерцательная аритмия по устаревшей классификации) – самая частая аритмия на Земле. Распространенность в популяции 1,5-2%, к 2050 году ожидается «эпидемия» фибрилляции предсердий.
Она характеризуется хаотичной электрической активностью предсердий, с частотой сокращения более 340 в минуту, при этом желудочки сердца также сокращаются с большой частотой и неритмично.
Пульс при этом, как правило, частый, неритмичный.
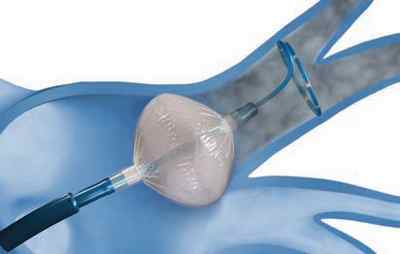
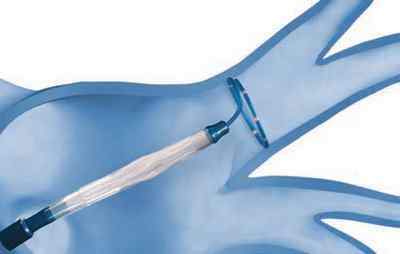
Рис. 3А Доступ к целевой вене
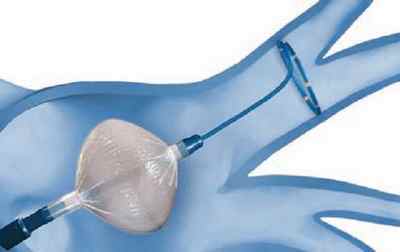
Рис. 3В Окклюзия (закупорка) и абляция устья легочной вены
Рис. 3Б Раздувание и позиционирование баллона
Рис. 3Г Сдутие баллона, контроль изоляции ЛВ
Подготовительный этап, этап доступа в левое предсердие сходные для обеих процедур. Процесс электрической изоляции легочной вены отличается. При криобаллонной изоляции баллон подводится к устью вены на специальном диагностическом проводнике-катетере.
Раздувается, полностью перекрывая на время воздействия кровоток по вене. Наноситься холодовое (крио) воздействие (рис 3).
Жидкий сжатый N2O поступает из криоконсоли к катетеру, происходит испарение N2O и абсорбция тепла из окружающих тканей, теплый газ отводится обратно в консоль, многочисленные системы безопасности контролируют утечку газа.
По окончанию воздействия баллон сдувается, восстанавливается кровоток по вене. С помощью специального циркулярного катетера оценивается эффект воздействия (рис 4), при необходимости процедура повторяется.
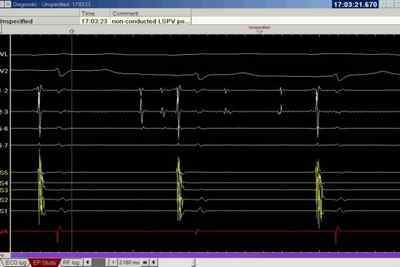
Рис. 4. Электрическая изоляция легочной вены после нанесения крио воздействия. Сохраняется активность в легочной вене (регистрация на каналах «Ach1-2» и «Ach6-7»), проведение на предсердие отсутствует: синусовый ритм по данным поверхностной ЭКГ и данным внутрисердечной регистрации (CS5-1)
В ходе процедуры проводится последовательная изоляция всех легочных вен. В отличие от метода поточечной радиочастотной абляции, циркулярное повреждение вокруг устья легочной вены происходит за одно воздействие. Это позволяет получить равномерное повреждение с ровными границами.
По окончании процедуры удаляются все электроды, интродьюсеры. Пациент переводится в палату, на ближайшие часы рекомендуется постельный режим. Длительность госпитализации составляет 3-4 дня.
Методика криобаллонной абляции устьев легочных вен эффективна, хорошо переносима, длительность процедур меньше, чем при радиочастотной изоляции.
К недостаткам метода можно отнести невозможность адаптировать криобаллон ко всем анатомическим вариантам строения левого предсердия и легочных вен, невозможность наносить воздействия вне устьев легочных вен, более высокая рентгенологическая нагрузка на медицинский персонал и пациента.
Решение о выборе метода лечения принимается врачом индивидуально, исходя из данных инструментальных обследований (ЭхоКГ, компьютерная томография левого предсердия в показанных случаях).
Операция криоабляция для лечения фибрилляции предсердий и левопредсердных тахиаритмий
Криоабляция сердца и ее эффективность
Источник: https://1serdce.pro/krioablyaciya-serdca-i-ee-effektivnost.html
Криоабляция — новый метод лечения рака
1182
Криоабляция как метод лечения рака основана на использовании низких температур с целью замораживания раковых опухолей при сохранении окружающей ткани. Криоабляция в основном выполняется чрескожным доступом, с минимальными болевыми ощущениями и косметическими дефектами после процедуры.
- При этом тонкая, похожая на вязальную спицу игла (криозонд) вводится через кожу прямо в раковую опухоль.
- Криотерапия применяется для лечения следующих заболеваний:
- • Рак почки
Жидкий азот, поступающий через криозонд, мгновенно замораживает ткань, после чего опухоль оттаивают и повторяют замораживание несколько раз в течение одного сеанса. Криоабляция для лечения рака может использоваться, когда операция не возможна или нежелательна по различным причинам. В последние годы этот инновационный метод все чаще становится альтернативой обычному хирургическому вмешательству. • Рак кости • Рак шейки матки • Рак предстательной железы • Рак молочной железы • Рак печени • Рак легких • Опухоли глаз и др. Криоабляция также используется для облегчения боли и других симптомов, вызванных раком, который распространяется на кость (метастазирование кости) и другие органы. Криоабляцию иногда называют криохирургией или криотерапией. Использование холода для облегчения боли, а также в качестве противовоспалительного средства было известно со времен Гиппократа. С тех пор собрано множество удивительных сообщений о применении льда, в том числе у древних египтян и Авиценны. С 1899 года доктор Кэмпбелл Уайт использовал хладагенты для лечения различных заболеваний, включая: красную волчанку, опоясывающий лишай, шанкроид, невусы, бородавки, варикозные язвы на ногах, карбункулы и раковые опухоли. Знаменитый врач и исследователь Де Кервен успешно применял сухой лед для лечения папиллом мочевого пузыря и рака мочевого пузыря еще в 1917 году. Доктор Ирвинг Купер в 1913 году усовершенствовал криотерапию, разработав систему для подачи жидкого азота, способную достигать температуры -196°C. С ее помощью возможно было лечить опухоли, ранее считавшиеся неоперабельными. Криозонд Купера стал началом современной криотерапии, что привело к растущему медицинскому интересу к этой области во всем мире. Уже в 1964 году доктор Каган успешно применил свое изобретение для измерения уровня жидкого азота с целью криоабляции миомы матки и злокачественных опухолей шейки матки. Благодаря технологическому прогрессу криозондов в 1960-х годах, лечение рака экстремально низкими температурами перестало быть фантастикой. С этого времени зарубежные врачи лечат с помощью криоабляции рак печени, опухоли предстательной железы, молочной железы, костей и др.
В частности, японский врач Танака начал успешно замораживать рак молочной железы в 1968 году. Его смелые эксперименты помогли сначала справляться с небольшими и четко локализованными опухолями, а в течение трех десятилетий минимально инвазивная криоабляция применялась при запущенном неоперабельном РМЖ.
В эти же десятилетия другие известные врачи, в том числе доктор Эблин и доктор Гейдж, начали использовать криоабляцию для лечения рака предстательной железы и кости. В 1980-х и 1990-х годах произошли революционные успехи в области технического обеспечения и методов визуализации благодаря внедрению CMS Cryoprobe и Accuprobe. МРТ, КТ, криозонды с ультразвуковым контролем становились более доступными и улучшали возможности криотерапии в геометрической прогрессии. Воодушевленные достижениями в области криотерапии, в 1990-х годах китайские врачи внедрили криоабляцию в лечение многих онкологических заболеваний.
Сегодня клиники КНР являются одними из лучших в данной области.
Учитывая очевидные преимущества метода для пациентов, FDA официально одобрило лечение рака предстательной железы с помощью криоабляции в 1998 году. Появилось много впечатляющих исследований, в том числе Ice3 по лечению РМЖ, которые открывают дорогу к широкому использованию недооцененной методики в онкологии. Основная привлекательность криоабляции и других абляционных технологий заключается в снижении инвазивности процедуры и получении хороших терапевтических эффектов с более эффективными косметическими результатами. Во время криотерапии через криозонд, введенный непосредственно в опухоль, пропускают сжиженный азот или аргон, который расширяется до газообразного состояния в конце зонда, создавая температуру до — 190°C. Разрушение опухолевых клеток достигается при температуре уже порядка — 20°С.
Для обеспечения полной абляции опухоли необходимо обрабатывать холодом периферический край примерно на 1 см.
После первой фазы замораживания следует фаза оттаивания с заменой сжиженного газа гелием или при помощи нагревания иглы изнутри в более современных системах. Весь процесс замораживания-оттаивания повторяется многократно для достижения эффективной абляции. При этом компьютерная томография идентифицирует замороженную область в режиме реального времени как область низкой плотности, соответствующую сформировавшемуся на конце зонда ледяному шарику (см. иллюстрацию).
Процедура приводит к очаговому разрушению опухолевой ткани минимально инвазивным способом со снижением риска осложнений и смертностью. Этот метод представляет собой экономически эффективную альтернативу традиционной хирургии.
Процесс замораживания начинается с формирования заметного на КТ или ультразвуке ледяного шарика возле поверхности зонда, охватывающего всю опухоль. Когда нужное количество ткани заморожено, поток газа прекращается и начинается оттаивание.
Инъекция солевого раствора может использоваться для увеличения расстояния между опухолью и кожей — например, при раке молочной железы, где они находятся слишком близко. Это помогает избежать повреждения кожи, вызванного гипотермией.
Обработанный участок, то есть опухолевая ткань, остается на месте для дальнейшего разрушения и поглощения с участием иммунной системы хозяина. Магнитно-резонансная томография (МРТ) изучается как альтернатива ультразвуку, но преимуществом последнего считается доступность и экономическая эффективность. Было предложено много гипотез, объясняющих, как криоабляция вызывает повреждение клеток. Главная теория заключается в том, что концентрированные растворенные вещества в области внеклеточного замораживания вызывают дегидратацию клеток, повреждение ферментативной системы и дестабилизацию клеточной мембраны. Достоверно известно, что внутриклеточный лед становится водой, проникающей внутрь клеток, когда происходит оттаивание. Обусловленное этим нарушение осмотического равновесия вызывает повреждение как внутриклеточных структур, так и мембраны. Замораживание также вызывает повреждение стенки кровеносных сосудов либо непосредственно в их клетках, либо в общей структуре. Вследствие того, что зона криоабляции покрывается ледяным слоем, кровь не попадает внутрь или наружу этой границы. Развивающаяся в результате ишемия плюс недостаток питательных веществ могут вызвать некроз в замерзшей области.
Hong et al. продемонстрировали, что клетки рака молочной железы более устойчивы к замерзанию по сравнению с нормальными клетками молочной железы. Плотно расположенная структура раковых клеток с меньшим количеством внеклеточного пространства делает их более устойчивыми к дегидратации.
Их наблюдение подтверждает предполагаемый внеклеточный эффект криоабляции на уничтожение опухолевых клеток. Повреждение от замерзания клеток карциномы молочной железы увеличивается с уменьшением температуры или ускорением скорости охлаждения.
Rui et al. сообщили, что два цикла замораживания / оттаивания дают лучший результат, чем один цикл лечения, а польза от трех или более циклов минимальна, если вообще имеет место.
Другое предполагаемое преимущество криоабляции заключается в том, что она может стимулировать иммунологический ответ, предотвращая местный и системный рецидив опухоли. Это основано на том факте, что присутствие опухолевых антигенов в воспалительной микросреде стимулирует иммунный ответ (см. иллюстрацию).
По одной из гипотез, криоабляция вызывает иммунный ответ только при определенном пути гибели раковых клеток, некрозе. Некроз освобождает внутриклеточное содержимое, которое стимулирует сигналы опасности, способные активизировать Т-лимфоциты для специфического иммунного ответа на разрушенную ткань. Наоборот, после гибели клеток в результате апоптоза высвобождаются апоптотические тела, без стимулирующих сигналов, поэтому Т-лимфоциты не активируются. Следовательно, апоптотический путь может обуславливать иммуносупрессию. Ряд исследований с раком молочной железы на ранних стадиях указывают, что процедура может проводиться амбулаторно. При этом общая анестезия или внутривенная седация не требуются. Это обусловлено биологическими эффектами низких температур.
- Криоабляционная анестезия выгодно отличается от деструкции, основанной на нагревании, тем, что последняя вызывает больше дискомфорта, чтобы потребовалась общая анестезия и значительная внутривенная седация в операционной.
- Следует отметить, что, хотя ультразвук четко показывает границу замораживания, заднее акустическое затенение предотвращает визуализацию внутреннего пространства ледяного шарика, не позволяя точно измерить точный размер последнего.
- Из недостатков криоабляции при раке следует отметить, что криоабляционный эффект отрицательно влияет на результаты анализов, в том числе определение статуса рецепторов эстрогена / прогестерона и статуса HER-2 / neu.
За процедурой легко наблюдать с помощью существующих методов визуализации, в том числе ультразвукового исследования, где проксимальный край ледяного шарика отчетливо визуализируется в виде гиперэхогенного обода. Вследствие того, что замороженные ткани остаются в опухоли и подвергаются последующей резорбции с течением времени, эта процедура имеет косметически приемлемые результаты и не оставляет выраженного рубца. Временные и легкие экхимотические изменения и отек являются основными косметическими дефектами после процедуры. Изменения пигментации кожи, наблюдаемые в очень редких случаях, называют одним из наиболее заметных побочных эффектов при длительном наблюдении за пациентами после лечения доброкачественных новообразований молочной железы. В целом, рубцевание считается минимальным, выздоровление происходит быстро, а эффективность лечения сочетается с высокой степенью удовлетворенности пациента. Возможное преимущество криоабляции состоит в том, что внутриклеточное содержимое поврежденных опухолевых клеток сохраняется и может распознаваться иммунной системой, инициирующей специфический иммунный ответ. Сочетание криотерапии с иммунотерапией усиливает иммуностимулирующий ответ и оказывает синергетический эффект при лечении рака. Основанный на данном принципе метод лечения носит название криоиммунотерапия (cryoimmunotherapy).
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Источник: https://medbe.ru/news/novosti-v-onkologii/krioablyatsiya-novyy-metod-lecheniya-raka/
Крио при лечении аритмии —
Корригируется ли фибрилляция предсердий медикаментозно? – вопрос в нашей газете за 2010 №44 был адресован к главному кардиологу МЗ РТ, профессору Альберту Сарваровичу Галявичу.
«Именно мерцательная аритмия требует к себе внимательного отношения.
Во-первых, необходимо провести грамотную диагностику с помощью ЭКГ, затем установить причину нарушения ритма – как правило, проводится детальное обследование сердца, и затем выбрать тактику ведения больного с фибрилляцией предсердий.
Добиться того, чтобы пульс был ритмичным возможно лекарственными препаратами. Используются средства, урежающие частоту сердечных сокращений, для того, чтобы «удержать» ритм сердца в промежутке от 60 до 80 ударов в минуту.
Есть препараты типа бета-блокаторов, которые урежают ритм сердца, не теряют своей актуальности и лекарственные средства, которые использовались кардиологами в течение многих лет.
Так или иначе, выбор того или иного препарата определяет врач, в зависимости от индивидуальных особенностей пациента, от того, какие сопутствующие заболевания имеются и так далее», — ответил главный кардиолог МЗ РТ.
Можно ли избавить человека, страдающего мерцательной аритмией, навсегда от этого недуга, решив проблему хирургически – это уже другой вопрос, на который в настоящий момент казанские хирурги могут ответить утвердительно.
Впервые в республике были проведены операции по лечению сложных нарушений ритма сердца с использованием современной технологии — криоабляции. Хирургические вмешательства выполнялись под руководством специалиста Федерального центра сердечно-сосудистой хирургии г.
Тюмени Григория Владимировича Колунина.
В чем суть методики, и каковы планы казанских аритмологов по внедрению криоабляции в практику — об этом в интервью с заведующим отделением рентгенхирургических методов диагностики и лечения Республиканской клинической больницы МЗ РТ Сергеем Александровичем Ереминым.
— Метод криоабляции представляет собой точечное воздействие холода на определенные участки сердца, которые являются источниками возникновения аритмии.
При криоабляции применяется жидкий азот, температура которого составляет от -40º до -80º С. Данный метод используется для лечения одного из наиболее распространенных видов аритмии — фибрилляции предсердий.
«Замороженные» участки, ответственные за образование очага аритмии, соответственно перестают участвовать в этом процессе.
- — Как определяются эти очаги формирования фибрилляции предсердий?
- — В ходе электрофизиологического исследования, заключительным этапом которого и является криоабляция.
- — Насколько актуальна проблема фибрилляции предсердий?
— Фибрилляции предсердий — заболевание, при котором предсердия сокращаются хаотично, вследствие чего сердце теряет способность совершать скоординированные сокращения.
Вследствие этого, большинство людей, страдающих фибрилляцией предсердий, имеют повышенный риск образования тромбов, которые, в силу своей подвижности, могут способствовать развитию инсульта.
Переход пароксизмальной формы фибрилляции предсердий в постоянную форму может способствовать развитию или прогрессированию хронической сердечной недостаточности. Именно поэтому необходимо уделять повышенное внимание, как лечению, так и профилактике нарушений ритма сердца.
— Каковы преимущества данной методики перед ранее применяемой радиочастотной абляцией? Можно ли их сравнивать?
— Показания для каждого пациента свои. В случае, когда необходимо хирургическое лечение фибрилляции предсердий нами используется и радиочастотная абляция, а теперь и криоабляция. Криоабляция – это, можно сказать, последнее слово в медицинской практике.
В мире методика применяется совсем недавно. Еще новее данный вид хирургического вмешательства для России. Если 4 года назад за рубежом проводились лишь экспериментальные операции по криоабляции, то сейчас направление широко распространяется у нас.
Если сравнивать методики, то криоабляция менее рискованна для здоровья пациентов, так как практически полностью исключает вероятность повреждения проводящих путей сердца. Также снижается вероятность тромбообразования.
Но по конечному результату и по времени проведения и радиочатотная абляция и криоабляция сопоставимы.
Криоабляция имеет две модификации – катетерная, которая, образно говоря, заменяет радиочастотную, и криобаллонная, применяемая при лечении фибрилляции предсердий – самого сложного вида аритмии.
Преимущества баллонной криоабляции заключается в том, что более эффективно и надежно изолируются устья легочных вен.
Легочные вены – признанный источник патологической пульсации, которая приводит к фибрилляции предсердий.
В левое предсердие впадают четыре легочные вены, и методика привлекательна тем, что специальным баллоном мы изолируем по очереди каждую из этих четырех вен и сжиженным газом до -40 ºС охлаждаем баллон, повреждая устье вены.
Проводится операция «за один заход», нет необходимости многократно делать точечные прижигания, как при радиочастотной абляции. Мы сразу получаем изоляцию всей вены, которую потом подтверждаем электрофизиологическим исследованием.
Это довольно большой шанс на излечение от такого недуга, как фибрилляция предсердий.
- — Какую роль играет функциональная диагностика в проведении криоабляции?
- — Функциональная диагностика – служба, которая направляет к нам пациентов, дает предварительный и часто окончательный диагноз, и определяет показания к операции.
- — Каковы перспективы развития данной методики?
— Мы будем расширять показания к проведению криоабляции – это больше всего касается пациентов с фибрилляцией предсердий. Сегодня таких оперированных пациентов немного – операция дорогостоящая, сложная, но будем надеяться, что возможности нашей республики для проведения данного вида оперативных вмешательств увеличатся.
Екатерина Лобанова
Метод криоабляции представляет собой точечное воздействие холода на определенные участки сердца, которые являются источниками возникновения аритмии. При криоабляции применяется жидкий азот, температура которого составляет от -40º до -80º С.
Криоабляция менее рискованна для здоровья пациентов, так как практически полностью исключает вероятность повреждения проводящих путей сердца. Также снижается вероятность тромбообразования.
Использованные источники: mfvt.ru
Крио-абляция при мерцательной аритмии
Одним из современных методов лечения фибрилляции предсердий (ФП) является криоабляция с использованием криобаллонного катетера. Как видно из названия, доставка холодового агента для заморозки ткани и прекращения неж елательных циркуляций электрических импульсов, способствующих возникновению и поддержанию ФП, осуществляется через раздуваемый баллон.
Криобаллонная абляция легочных вен – это безопасный, эффективный и простой метод для лечения ФП.
Криобаллонная абляция подтвердила свою эффективность более чем у 100 000 пациентов в 800 клиниках по всему миру.
Благодаря форме баллона, доступ к легочной вене (области нежелательных циркуляций электрических токов, поддерживающих ФП) быстр и эффективен. Как и при любой медицинской процедуре, при катетерной абляции есть свои преимущества и риски.
Как это работает
С помощью холодового воздействия создается блок перехода нежелательных электрических импульсов с легочных вен (крупные кровеносные сосуды, которые приносят кровь от легких в левое предсердие) и их распространение по предсердиям (верхние камеры сердца).
Это обеспечивается процедурой, известной как изоляция легочных вен, направленная на абляцию ткани в месте соединения легочных вен с предсердием и прекращение распространения с них нежелательных электрических импульсов.
Во время процедуры врач делает прокол в паховой области, через который вводит катетер, далее катетер проводится в правое предсердие сердца. Затем хирург делает пункцию межпредсердной перегородки (стенки, которая разделяет правую и левую части сердца). Пункция позволяет обеспечить доступ в левое предсердие.
Криобаллонный катетер вводится в левое предсердие. Врач раздувает баллон и продвигает его ко входу в легочную вену. Цель – закрыть место впадения легочной вены полностью, что остановит поток крови между предсердием и веной (это называется окклюзией). Как только окклюзия подтверждена, врач вводит сжиженный холодовой агент в криобаллон.
Испаряясь, холодовой агент забирает тепло из ткани сердца – там, где баллон контактирует с ней, в области впадения легочной вены. В результате на ткани формируется рубец, и она не может больше проводить электрические токи, которые были причиной мерцательной аритмии.
Использованные источники: mertsalka.net
Криоабляция сердца
Криоабляция сердца
Cardiac Catheter Cryoablation (Cryotherapy; Cryoablation)
Описание
Криоабляция использует воздействие чрезвычайно низких температур для разрушения клеток. Криоабляция сердца используется для уничтожения патологических клеток сердца.
Причины проведения процедуры
Процедура проводится чтобы «отключить» клетки сердца, которые создают нарушение сердечного ритма (аритмия). После процедуры нормальный сердечный ритм должен быть восстановлен.
Возможные осложнения после криоабляции сердца
Осложнения встречаются редко, но никакая процедура не гарантирует отсутствие риска. Перед тем, как выполнить процедуру, нужно знать о возможных осложнениях, которые могут включать:
- Кровотечение;
- Инфекция;
- Боль в месте введения катетера;
- Сгустки крови;
- Травмы кровеносных сосудов и сердца;
- Аномальный сердечный ритм;
- Сердечный приступ;
- Прокол сердца.
Факторы, которые могут увеличить риск осложнений включают в себя:
Уровень риска может быть связан с конкретным типом аритмии.
Как проводится криоабляция?
Подготовка к процедуре
Врач, скорее всего, выполнит следующие действия:
- Электрофизиологическое исследование (ЭФИ сердца), чтобы точно определить расположение аномальных ритмов;
- Попросит прекратить принимать лекарства, которые ранее использовались для лечения аритмии.
В преддверии процедуры:
- Не надо ничего есть или пить в течение восьми часов перед процедурой;
- Следуйте инструкциям врача.
Анестезия
Буде введен местный анестетик. Он обезболит область, где будет вставлен катетер. Вы также получите мягкое седативное через капельницу в руку. Это поможет вам расслабиться во время процедуры.
Описание процедуры
Специальный катетер для абляции будет вставлен в кровеносный сосуд в паху, верхней части бедра, руки или на запястье. Область введения катетера будет очищена и обезболена с помощью анестезии.
Катетер будет введен в артерию и подведен к кровеносным сосудам в сердце. Врач сможет увидеть катетер на экране специального рентгеновского аппарата.
Врач находит источник аритмии. Это будет сделано путем определения места аритмии специальным наконечником катетера. Как только проблемное место будет найдено, оно будет охлаждено с помощью кончика катетера. Если место источника аритмии найдено правильно, проблема исчезнет. Если место выбрано ошибочно, холодный конец катетера удаляется и ткань не будет иметь никаких повреждений.
Когда место возникновения аритмии определено правильно, конец катетера будет охлажден до -70°C. Это заморозит ткань сердца и устранит аритмию. Процедура поиска повторяется, пока не будут устранены все источники аритмии.
Сразу после процедуры
Вы будете перемещены в послеоперационную палату. Персонал будет наблюдать за жизненными показателями в течение нескольких часов для обнаружения симптомов болезненности, проблем с сердечным ритмом, кровотечения из места введения катетера.
Необходимо лежать на спине в течение некоторого периода времени. На месте, где был вставлен катетер, может быть наложена повязка чтобы предотвратить кровотечение. Важно следовать указаниям медсестры и врача.
Сколько времени займет процедура?
3-6 часов (иногда больше).
Будет ли это больно?
Вы можете почувствовать некоторые незначительные неудобства во время введения катетера. Может также чувствоваться головокружение, учащенное сердцебиение, боли в груди в процессе замораживания.
Среднее время пребывания в больнице
Большинство пациентов должны остаться в больнице на ночь для дальнейшего наблюдения. Врач может продлить пребывание, если возникают осложнения.
Уход за пациентом после криоабляции сердца
Уход в больнице
- В месте введения катетера могут быть синяки и боль;
- Если катетер вводился в паховой области нужно некоторое время лежать в постели с выпрямленными ногами;
- Если катетер вводился в запястье или руку, оставаться в постели не нужно;
- Место введения катетера будет контролироваться на наличие признаков кровотечения, отека или воспаления;
- Будут контролироваться жизненные параметры.
Уход на дому
Когда вы возвращаетесь домой после процедуры, выполните следующие действия, чтобы обеспечить нормальное восстановление:
- Принимайте аспирин по назначению в течение 2-4 недель. Это поможет снизить риск образования тромбов в месте введения катетера;
- Можно вернуться к обычной деятельности, разрешается ходьба или подъем по ступенькам. Воздержитесь от тяжелых или физических нагрузок в течение 24 часов. В большинстве случаев вы сможете вернуться к нормальному уровню активности в течение нескольких дней;
- Своевременно нужно наносить визиты к врачу. Места введения катетера должны быть проверены на отсутствие осложнений.
У этой процедуры чрезвычайно высокая частота успеха и низкий риск развития осложнений. Однако:
- При наличии фибрилляции предсердий или желудочковой тахикардии, возможно, придется продолжать антиаритмическую терапию;
- После криоабляции АВ узла, вам потребуется кардиостимулятор.
Связь с врачом после криоабляции сердца
После возвращения домой нужно обратиться к врачу, если появились следующие симптомы:
- Признаки инфекции, включая лихорадку и озноб;
- Покраснение, отек, усиление боли, кровотечение, или выделения в месте установки катетера;
- Нога, в которую вводился катетер, мерзнет, становится белой или голубой, затекает или возникает покалывание;
- Кашель, одышка, боль в груди, или сильная тошнота или рвота;
- Дискомфорт в челюсти, груди, шее, руке, или верхней части спины;
- Головокружение и слабость.
Использованные источники: medicalhandbook.ru
Источник: http://PrimeOils.ru/lechenie/krio-pri-lechenii-aritmii
Криоабляция в онкологии: показания, достоинства и недостатки
Принцип действия криотерапии
Важнейшая цель любого метода лечения злокачественных новообразований – полное удаление раковых клеток.
Криоабляция опухолей предполагает использование методики экстремального замораживания тканей (до — 50° C) специальными хладагентами (жидкий азот, аргон), которые создают условия для разрушения клеточных структур новообразования.
Важными условиями успешного использования криотерапии являются четкое определение показаний для операции и правильный выбор методики лечения.
Показания для криоабляции
Оптимальный лечебный эффект от криодеструкции можно получить в борьбе с хорошо доступными опухолями. Криоабляция рака используется в следующих случаях:
- опухоли шейки матки (цервикальная неоплазия, карцинома in situ);
- заболевания молочной железы (фиброаденома, пролиферативные формы мастопатии);
- патология предстательной железы (аденома, начальные формы злокачественного перерождения);
- рак кожи;
- опухоли внутренних органов (почки, печень).
Чаще всего криотерапия используется при заболеваниях кожи и предопухолевой патологии шейки матки. Криоабляция молочной железы выполняется только при гарантированном отсутствии злокачественного перерождения клеток на этапе предраковых процессов. Для криотерапии печени и почек требуется проведение операции с применением специального оборудования.
Варианты криодеструкции
- Поверхностный (на коже);
- Местный (воздействие на опухоль, расположенную близко от кожи или слизистой оболочки);
- Эндоскопический (хирургический доступ к новообразованию через оптические инструменты).
В каждом конкретном случае врач применяет методику с обязательным учетом диагноза и возможного риска рецидива заболевания.
Достоинства и недостатки метода
Основными преимуществами криодеструкции в онкологии являются:
- эффективное удаление склонных к злокачественному перерождению клеток;
- минимальная травматизация здоровых тканей;
- быстрое заживление раны;
- отсутствие болевых ощущений;
- отсутствие необходимости длительного нахождения в больнице;
- низкая вероятность формирования косметических дефектов.
Несомненным достоинством криоабляции фиброаденомы или опухоли на коже является крайне невысокий риск образования рубцов и шрамов на кожных покровах.
Из недостатков криотерапии следует отметить следующие моменты:
- необходимость создания определенных условий для криоабляции (хранение хладагента, наличие специального инструментария);
- низкая эффективность методики при глубоком прорастании опухоли;
- возникновение риска осложнений во время операции (кровотечение, повреждение соседних анатомических образований);
- возможность рецидива болезни.
Метод криодеструкции оптимален при предопухолевых состояниях, когда малоинвазивная операция поможет предотвратить развитие злокачественного новообразования.
Источник: https://cancer-care.ru/krioablyatsiya-v-onkologii/
Криоабляция при фибрилляции предсердий
3 июня в рамках VI Конгресса кардиологов Казахстана в НИИ кардиологии и внутренних болезней г. Алматы был проведен интерактивный мастер-класс в режиме on-line «Криоабляция при фибрилляции предсердий».
Операция была проведена хирургами НИИ кардиологии и внутренних болезней, прошедшими обучение технологии использования криобаллона нового поколения.
После проведения операции о преимуществах технологии рассказали специалисты клиники Асклепиос, Гамбург.
Фибрилляция предсердий (ФП), или мерцательная аритмия, опасна в первую очередь своими осложнениями: тромбозом, развитием инсультов, зачастую приводящих к инвалидности и даже летальному исходу.
Самыми распространенными факторами риска возникновения ФП являются возраст, мужской пол, артериальная гипертензия, сахарный диабет, гипертиреоз и структурная патология сердца. В частности, пороки митрального клапана и гипертрофическая кардиомиопатия могут повлечь за собой изменения предсердной ткани.
Сердечная недостаточность и систолическая и диастолическая дисфункция как ее следствие также способствуют возникновению ФП.
Одним из современных хирургических методов лечения ФП является криоабляция – точечное воздействие холода на определенные участки сердца, являющиеся источниками аритмии. Показанием к хирургическому вмешательству при ФП является аритмия, сопровождающаяся клиническими симптомами и рефрактерная к приему одного и более антиаритмических препаратов.
Метод криоабляции основан на внутриклеточных процессах, происходящих при низких температурах. Так, при температуре 20°С внутри клетки происходит образование льда, что приводит к изменению осмотического давления и дегидратации клетки.
Температура −40°С влечет за собой необратимое повреждение клеточных органелл. В процессе повреждения тканей играет роль также процесс оттаивания, во время которого происходит дальнейшее повреждение внутри- и внеклеточных структур.
Работа системы для криоабляции обеспечивается путем доставки жидкого оксида азота, находящегося под давлением, на дистальную часть катетера или внутрь баллона.
Далее происходит испарение азота и охлаждение окружающих тканей. Образовавшиеся в результате ледяные кристаллы повреждают мембрану клетки, нарушают клеточный метаболизм и электрическую активность.
К гибели клеток приводит также локальное нарушение кровотока в зоне воздействия.
Во время операции через пункцию в полость левого предсердия вводится сначала проводник, через него – сдутый баллон. Далее баллон раздувается и устанавливается в легочной вене таким образом, чтобы достичь полной ее обструкции. После этого для подтверждения обструкции и контакта баллона с тканью вводится контраст, который не должен проникать из легочной вены в полость левого предсердия.
Внутри баллона имеется просвет для проведения катетера, который позволяет в режиме реального времени увидеть потенциалы легочных вен и исчезновение их во время заморозки. Для того чтобы иметь возможность оценить потенциалы легочных вен, петлю катетера следует располагать проксимально (такое положение позволяет увидеть сигналы в 80–90% случаев).
В настоящее время доступно 2 размера баллонного катетера – диаметром 23 и 28 мм. Преимуществом криоабляции является то, что при установке баллона внутри левого предсердия внутри него находится проводник, что делает технологию достаточно безопасной и удобной в использовании.
Кроме того, это единственная технология, которая позволяет добиться изоляции легочной вены с помощью одной аппликации: после начала заморозки происходит циркулярное повреждение по всей окружности легочной вены.
Следующее преимущество данной технологии – короткий период обучения специалистов.
До недавнего времени в Казахстане при проведении данного вмешательства использовались криобаллоны первого поколения, имевшие определенные недостатки. Первые криобаллоны начали использоваться в 2006 г.
Их особенностью было расположение инъекционных отверстий в проксимальной части баллона, в результате чего зона максимального охлаждения располагалась в районе экватора, т. е. часть баллона ближе к его носику не охлаждалась достаточным образом.
При погружении баллона под воду можно было наблюдать образование льда в районе экватора, в дистальной части баллона лед не образовывался.
Результаты 3-летнего наблюдения за пациентами после проведения им криоабляции баллоном 1-го поколения продемонстрировали эффективность проведенного лечения в 61,6% случаев, что соответствует эффективности при проведении радиочастотной абляции.
Во время проводимого в НИИ кардиологии и внутренних болезней мастер-класса был продемонстрирован криобаллон 2-го поколения, в котором количество инъекционных отверстий, через которые поступает хладагент, увеличено с 4 до 8. Это позволило увеличить зону охлаждения и сместить ее от экватора ближе к дистальной части баллона.
Охлаждение с применением криобаллона 2-го поколения стало более эффективным и более равномерным, что позволило сократить время аппликации с 5 мин, которые требовались при применении криобаллона 1-го поколения, до 4 мин. Кроме того, использование криобаллона 2-го поколения позволяет достигать более низких температур – до −48°С.
Специалисты клиники Асклепиос представили результаты собственных наблюдений за пациентами с ФП после проведения им криоабляции с применением криобаллона 2-го поколения. В исследовании принимали участие 115 пациентов, средний возраст – 61 год, 81% имели проксимальную ФП. Успешность проведенного лечения была отмечена в 99% случаев.
Среди осложнений, возникающих в результате криоабляции, наиболее распространенным является поражение диафрагмального нерва (по данным клиники Асклепиос, оно наблюдалось у 4 из 115 пациентов), которое в части случаев восстанавливается в течение проведения процедуры.
Однако бывают случаи, когда процесс восстановления проведения по диафрагмальному нерву более длителен (до 10 мес).
В исследовании, проведенном в США, частота развития повреждения диафрагмального нерва составляла 6,4%, также отмечались редкие случаи развития стеноза легочных вен (0,9%) и повреждения слизистой пищевода (5,2%).
Известно, что пищевод расположен очень близко к задней стенке левого предсердия, поэтому во время проведения криоабляции существует риск его повреждения. Изъязвления слизистой либо поверхностные повреждения пищевода были выявлены у 10% пациентов клиники Асклепиос.
Тем не менее ни у одного из этих пациентов не наблюдалось никаких клинических проявлений, для достижения скорейшего выздоровления назначался пантопразол в течение 6 нед 1 раз в день.
Для обеспечения максимальной безопасности пациентов в клинике Асклепиос используется специальный термодатчик, который помещается в пищевод.
При достижении в нем температуры +10°С абляцию прекращают. Это позволило снизить частоту повреждений слизистой пищевода практически до 0.
На сегодняшний день имеется 2 публикации, посвященные эффективности криоабляции с применением криобаллона 2-го поколения. Так, специалисты из Брюсселя сообщают, что эффективность однократно проведенной процедуры составляет 82%. По результатам клиники Асклепиос, эта эффективность достигает 80%.
Все пациенты находятся в стабильном синусовом ритме без применения каких-либо антиаритмиков на протяжении 12 мес.
Из этих 80%, у которых вмешательство было успешным, большую часть составляют пациенты с проксимальной ФП, однако в этой группе имеются и больные с персистирующей ФП, что позволяет сделать вывод об эффективности данной технологии в отношении обеих форм ФП.
В настоящее время в Европе проводится многоцентровое исследование с целью сравнения эффективности криоабляции и радиочастотной абляции. Пациенты, к которым будет применена та либо другая процедура, будут находиться под наблюдением в течение 12 мес.
Заключение
Применение криобаллона 1-го поколения продемонстрировало достаточно высокую эффективность и безопасность, однако эффективность этой технологии не превышает таковую при проведении радиочастотной, лазерной абляции и т. д.). Эффективность процедуры с применением криобаллона 2-го поколения значительно превышает таковую при использовании криобаллона 1-го поколения у пациентов как с проксимальной, так и с персистирующей ФП.
Подготовила Адема Муздабаева
Источник: https://health-kz.com/2014/05/13/krioablyatsiya-pri-fibrillyatsii-predserdiy/
Рча или криоаблация?
Донецкая О.П., Дзвониская В.Н.
Как известно, изоляция легочных вен, порождающих хаотические электрические сигналы, которые вызывают фибрилляцию предсердий, – стандартный метод лечения пациентов с фибрилляцией предсердий.
При криобаллонной абляции с помощью охлаждающего вещества создаются круговые смежные зоны поражения и таким образом изолируются легочные вены, тогда как при радиочастотной абляции для этих целей используется тепло (радиочастотная энергия), но при этом дополнительно необходимы трехмерное картирование и пошаговое воздействие.
«Пламя и Лед» ( FIRE AND ICE) – самое широкомасштабное рандомизированное международное клиническое исследование, цель которого – сравнить два метода аблации, используемых для лечения фибрилляции предсердий, а именно криоаблации («Лед»), в которой применяются криобаллоны Arctic Front, и радиочастотной абляции («Пламя») с помощью радиочастотных аблационных катетеров ThermoCool
Результаты исследования, были представленные на шестьдесят пятой ежегодной научной сессии Американского колледжа кардиологии 2-4 апреля 2016 года и одновременно опубликованы в журнале The New England Journal of Medicine.
Руководителем исследования выступил известный профессор Карл-Хайнц Кук (Karl-Heinz Kuck), директор кардиологического отделения клиники Asklepios Klinik St. Georg в Гамбурге, Германия.
В ходе исследования было задействовано 769 пациентов из 16 медицинских центров по всей Европе.
Все субъекты исследования имели диагноз «пароксизмальная фибрилляция предсердий», у них был неэффективен хотя бы один антиаритмический лекарственный препарат, и после первой аблационной процедуры они наблюдались у врача не дольше 33 месяцев (среднее значение = 1,54 года). Основная задача исследований такого типа – доказать, что новая технология сопоставима с общепринятой существующей технологией.
В ходе исследования была достигнута первичная конечная точка по критерию эффективности – доказано, что криобаллонные аблация не уступает радиочастотной аблации (p=0,0004) с точки зрения снижения частоты рецидивов аритмии или необходимости в антиаритмической медикаментозной терапии и/или повторной абляции. Также была достигнута первичная конечная точка по критерию безопасности, а именно по времени до первой смерти по любой причине, до инсульта или ТИА (транзиторная ишемическая атака) по любой причине либо до серьезных нежелательных явлений в связи с лечением (p = 0,24).
Обе технологии показали сравнимые низкие коэффициенты возникновения осложнений.
Согласно результатам исследования, технология криобаллонной аблации обеспечивает более короткую продолжительность процедур (среднее значение = 124 минуты) в сравнении с группой радиочастотной абляции (среднее значение = 141 минута; p = 0,0001), однако при этом применение радиочастотного катетера позволяет использовать рентгеноскопию более короткое время (среднее значение = 17 минут) по сравнению с криобаллонным аблационным катетером (среднее значение = 22 минуты; p = 0,0001).
Авторы исследования заявили, что, по их мнению, полученные результаты будут способствовать тому, что интервенционные аритмологические вмешательства перестанут быть уделом узкоспециализированных клиник и станут доступны врачам с менее высоким уровнем подготовки.
Если аблацию фибрилляции предсердий можно будет проводить легко и с достаточным уровнем безопасности, то, вероятно, лечение будет получать большее количество пациентов и, возможно, на более ранней стадии заболевания.
Возможно, когда-то с фибрилляцией будут поступать так же, как сейчас рекомендуется делать при синдроме WPW — выполнять вмешательство после первого же пароксизма.
Несмотря на то, что обсуждаемое исследование было проведено на не очень большой выборке пациентов, ожидается, что полученные результаты могут изменить существующие клинические рекомендации. В частности, возможно, ее учтут эксперты, работающие в настоящее время над третьим обновлении консенсусного заявления Общества по изучению сердечного ритма (HRS).
В июне 2016 года на последнем европейском конгрессе CARDIOSTIM были представлены результаты, касающиеся вторичных конечных точек.
Исследование продемонстрировало значительно меньшее количество потребности в повторных аблациях и более низкие показатели госпитализации больных с пароксизмальной формой фибрилляции предсердий в группе изоляции легочных вен с помощью криобаллона.
Качество жизни оценивали исходно и через 6 месяцев после процедуры, данные были сопоставимы в исследуемых группах.
Таким образом, криобаллонная аблация – безопасный и эффективный метод, который позволяет сократить продолжительность процедуры, сделать график лечения более предсказуемым по времени, уменьшить потребность в повторных процедурах, снизить количество госпитализаций и улучшить качество жизни больных.
Статья добавлена 27 июня 2016 г.
Источник: https://volynka.ru/Articles/Text/1481



 Криозонд Купера стал началом современной криотерапии, что привело к растущему медицинскому интересу к этой области во всем мире. Уже в 1964 году доктор Каган успешно применил свое изобретение для измерения уровня жидкого азота с целью криоабляции миомы матки и злокачественных опухолей шейки матки. Благодаря технологическому прогрессу криозондов в 1960-х годах, лечение рака экстремально низкими температурами перестало быть фантастикой. С этого времени зарубежные врачи лечат с помощью криоабляции рак печени, опухоли предстательной железы, молочной железы, костей и др.
Криозонд Купера стал началом современной криотерапии, что привело к растущему медицинскому интересу к этой области во всем мире. Уже в 1964 году доктор Каган успешно применил свое изобретение для измерения уровня жидкого азота с целью криоабляции миомы матки и злокачественных опухолей шейки матки. Благодаря технологическому прогрессу криозондов в 1960-х годах, лечение рака экстремально низкими температурами перестало быть фантастикой. С этого времени зарубежные врачи лечат с помощью криоабляции рак печени, опухоли предстательной железы, молочной железы, костей и др.