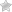- 22 Июня, 2018
- Онкология
- Волощук Наталя
Сегодня в мире существует большое количество наследственных заболеваний, которыми страдают дети. Одним из самых тяжелых считается хроническая гранулематозная болезнь.
Принято считать данный недуг первичным иммунодефицитом, хотя у больных существует иммунитет ко многим вирусам, бактериям и грибам. Поэтому такие люди не считаются полностью инфицированными.
Они долгое время могут жить без болезней, а потом инфицироваться тяжелым недугом, который будет угрожать их жизни.
Описание
Гранулематозная болезнь представляет собой нарушение структуры или отсутствие фермента НАДФН-оксидазы на генетическом уровне, что ускоряет процесс восстановления компонентов кислорода до его перерождения в супероксид — главную часть метаболического взрыва, в результате которого образуется активная форма кислорода и перекись водорода. Вследствие этих реакций образуются токсичные для болезнетворных бактерий продукты. Супероксид в нормальных физиологических условиях способен постоянно образовываться в клетках. При данной патологии в организме не происходит гибель микроорганизмов внутри клетки. Клетки, у кого имеется хроническая гранулематозная болезнь, вырабатывают антитела обычных типов, поэтому не обладают повышенной чувствительностью к вирусам, в отличие от больных с врожденными патологиями лимфоцитов. У больных может наблюдаться диффузный гранулематоз внутренних органов, что сопровождается болевыми ощущениями.
Виды
Медицине известны варианты расположения и характер изменений в генах, которые стали причиной болезни. Сегодня изучаются особенности данных преобразований. Существует три типа заболевания:
- К первому типу относят больных с полным отсутствием способности создавать связи в клетках. Таких сегодня около 75 процентов.
- Больные с небольшим недостатком фермента, имеющие структурную патологию.
- Люди с полным нарушением создания и деятельности НАДФН-оксидазы.
Тип наследования
Гранулематозная болезнь является генетическим недугом, что может передаваться по наследству. Медицине известны два пути передачи болезни потомству.
В большинстве случаев заболевание наследуется как связанный с Х-хромосомой признак, все остальные виды недуга передаются как аутосомные признаки.
Важно точно установить тип заболевания, чтобы определить риск развития недуга у последующего потомства.
Этиология
Хроническая гранулематозная болезнь детей проявляется в первые месяцы жизни. Онанаблюдается у одного раза на один миллион человек. Чаще всего болеют мальчики, девочки составляют около 20%. Больные женщины обычно не страдают тяжелыми инфекциями, но иногда наблюдались кожные инфильтраты.
Клиника
Больные страдают инфекциями в тяжелой форме, которые повторяются периодически. Подвержены инфицированию части тела, которые контактируют с бактериями. Появляются гнойные образования на коже или периодонтит.
Хронический гранулематозный периодонтит обуславливается переходом инфекции из оболочки зуба в кость, что касается его корня. Образования на коже проявляется в виде экзем вокруг носа и рта, сопровождающиеся гнойными аденитами.
Также в печени человека наблюдаются стафилококковые гнойные воспаления тканей, остеомиелит в костях. В местах попадания в кости и мягкие ткани образуются грамотрицательные бактерии.
Если очаг активен и поддерживается микрофлорой, что активно развивается в корне зуба, организм строит барьер для его изоляции, так появляется гранулема. Он изолирует источник инфекции, снижает всасывание и распространение микробов.
У больных часто происходит обострение хронического гранулематозного периодонтита, история болезни многих пациентов позволяет говорить о том, что данное заболевание присуще всем, кто имеет гранулематозную болезнь. У больных также наблюдается воспаление лимфоузлов, кишечника, легких и костей. Из грибковых поражений выделяют кандиоз, апергиллез. Часто наблюдается воспаление на месте прививки БЦЖ.
Симптомы
Главным признаком развития заболевания являются гранулемы. Они появляются в результате развития тяжелых инфекций, что повторяются. Частота повторений при этом зависит от вида заболевания. Гранулемы образуются на коже и слизистых оболочках, лимфатических узлах и легких.
Хроническая гранулематозная болезнь, первичный иммунодефицит, проявляется обычно в детском возрасте в виде остеомиелита, менингита, печеночных абсцессов, стоматитов, сепсиса, а также острой пневмонии с высоким процентом смертности и периодонтита. Опасны также грибковые инфекции, так как они поражают почки, пищевод и мочевой пузырь.
Часто отмечается анемия, увеличение СОЭ, гипергаммаглобулинемия. Больные имеют нарушения роста.
Диагностика
Основным методом диагностики данного недуга является тест NBT и исследование хемолюминесценции нейтрофилов. Данные методы являются эффективными, но требуют тщательного проведения. Также проводят анализы крови, ультразвуковое исследование и компьютерную томографию брюшной полости, рентгенографию грудной клетки.
В некоторых случаях применяют генетические исследования с целью выявления дефектов соответствующих генов. Врач проводит анализ анамнеза семьи и осмотр самого пациента. Широко применяется проточная цитометрия для определения наличия в фагоцитах вредных бактерий, а также остеосцинтиграфия для выявления патологических процессов в костях.
Требуется также проконсультироваться с генетиком.
Лечение
Хроническая гранулематозная болезнь, симптомы и лечение которой мы рассматриваем, требует назначения противобактериальных и противогрибковых препаратов, а также иммуномодуляторов. Используют для лечения и гамма-интерферон. При поверхностных абсцессах назначается пункционное дренирование.
При тяжелой форме заболевания, когда существует риск получения инвалидности, используется аллогенная трансплантация стволовых клеток. Но такая операция проводится только в специальных клиниках. Экспериментальным методом лечения выступает генная терапия. Есть сообщения об успешном ее проведении и полном излечении недуга.
Используют для лечения также кортикостероиды – гормоны, что обладают противовоспалительным действием – для лечения гранулем.
Осложнения
Очаги инфекции и осложнения могут наблюдаться на любых органах. Заболевание может привести к энтериту (воспаление тонкой кишки), пневмонии, остеомиелиту, сепсису, а также к летальному исходу. Может наблюдаться заражение клебсиеллой, золотистым стафилококком, стрептококком и пневмококком.
Прогноз
Хроническая гранулематозная болезнь может быть излечена, но это редкие случаи. Большинство людей с этим заболеванием доживают до старости, многие даже имеют здоровых детей. За последнее время качество жизни больных улучшилось. Современная медицина дает возможность долгое время не подвергаться воздействию инфекций.
Предосторожность
Медики рекомендуют больным плавать в тех бассейнах, где проводится тщательное хлорирование.
В открытой воде находятся микроорганизмы, что не вызывают у здоровых людей инфицирование, но у кого наблюдается хроническая гранулематозная болезнь, могут заразиться инфекцией.
Огромная опасность для больных представляет собой садовый перегной, поэтому не рекомендуется с ним работать. Микроорганизмы, что в нем содержатся. Могут вызвать развитие острой ингаляционной пневмонии. Нужно также не контактировать с пылью.
Профилактика
Специфической профилактики не существует, так как заболевание наследственное. Врачи рекомендуют с целью профилактики употреблять антибактериальные и противогрибковые препараты. Необходимо также планировать беременность и правильно к ней готовиться. Рекомендуется проводить диагностику на патологию во время беременности и перед родами, также нужна консультация генетика.
Таким образом, хроническая гранулематозная болезнь является наследственной и связана она с патологией иммунных клеток, что защищают человеческий организм путем фагоцитоза вредных бактерий и мертвых клеток.
Из-за патологии происходит снижение антимикробной активности клеток, в результате чего они могут поглотить патоген, но не могут его расщепить внутри себя. Медицинский генетик должен правильно выявить тип наследования заболевания, чтобы иметь возможность определить вероятность передачи недуга от родителей к детям.
Сегодня жизнь пациентов с данным заболеванием протекает нормально, в некоторых случаях недуг удалось излечить полностью.
Источник: https://SamMedic.ru/331252a-hronicheskaya-granulematoznaya-bolezn-simptomyi-i-lechenie
Синдром первичного иммунодефицита: диагностика, лечение, прогноз
07.06.2018
Иммунная система человека предназначена для того, чтобы вовремя реагировать на вторжение чужеродных элементов. Правильная её функциональность — это распознавание угрозы и её уничтожение.
Первичный иммунодефицит означает, что у ребёнка не сформировался защитный механизм при внутриутробном развитии, либо он не получил его по наследственному фактору. В результате попадающие в его организм вредоносные микроорганизмы будут приносить ему максимальный вред.
То же самое можно сказать об атипичных клетках, которые оказывают негативное влияние на состояние здоровья, вызывают патологии различной тяжести.
Первичные иммунодефициты классификация
Следует различать первичные и вторичные иммунодефициты. Первичный определяется у младенца вскоре после рождения.
Его организм лишён возможности защищаться от антигенов, подвержен инфекционному вторжению.
Это выражается в том, что малыш часто болеет, его одолевают повторные недуги, он трудно переносит их, получает осложнения. Тяжёлые формы первичного иммунодефицита приводят к смерти в младенчестве.
Известны редчайшие случаи, когда первичная иммунная недостаточность проявлялась у взрослых. Такое возможно, но для этого у человека должна быть высокая компенсированность определённой разновидности болезни.
Клиника заболевания — это повторное инфицирование, переход болезней в хроническую форму. К чему приводит первичный иммунодефицит:
- Пациент страдает бронхолегочными аномалиями.
- У него поражаются слизистые оболочки и кожный покров.
- Есть проблемы с ЛОР-органами.
- ПИДС, как правило, приводит к лимфадениту, абсцессам, остеомиелиту, менингиту, сепсису.
- Определённые формы первичного иммунодефицита провоцируют аллергии, аутоиммунные заболевания, рост злокачественных новообразований.
Изучением нарушений функций иммунной защиты занимается иммунология — наука о развитии и становлении защитного механизма, противодействующего проникновению антигенов в организм и уничтожающего повреждённые вредоносными веществами и микроорганизмами клетки.
Чем раньше диагностирован ПИДС, тем больше шансов у ребёнка выжить и продолжать жизнь с удовлетворительным состоянием здоровья. Важное значение имеет своевременное определение генной мутации, которая даёт возможность определиться с планированием семьи.
Иммунодефицитом считается стойкая аномалия защитного механизма, которая порождает сбой в иммунном ответе на влияние антигенов. Этот сбой может быть четырёх видов:
- возрастной, то есть возникший в детстве, либо в преклонном возрасте;
- приобретённый из-за неправильного питания, образа жизни, приёма лекарств, вируса СПИД и т. д.;
- развившийся в результате различных инфекций;
- врождённый или первичный ИД.
ПИДС классифицируются в зависимости от форм и тяжести заболевания. К первичным иммунодефицитам относятся:
- ИД характеризующийся поражением нескольких клеточных комплексов;
- Дисгенез ретикулярный, при котором стволовые клетки отсутствуют, это обрекает новорождённого на смерть.
- Тяжёлый комбинированный ИД — наследственное заболевание, обусловленное дисфункцией В и Т-лимфоцитов.
- Синдром Ди Джорджа — или аномалии тимуса, паращитовидных желёз — недоразвитость, либо отсутствие вилочковой железы. В результате дефекта поражаются Т-лимфоциты, возникают врождённые пороки сердца, деформации в костной структуре, строении лицевых костей, почечные дефекты и дисфункции ЦНС.
- Первичный иммунодефицит, обусловленный поражением В-лимфоцитов.
- Нарушения в миелоидных клетках, провоцирующих хроническую гранулематозную болезнь (ХГБ) с аномалией в кислородном обмене. Дефект выработки активного кислорода влечёт хронические грибковые и бактериальные инфекции.
- Дефекты сложных белков крови, нарушающих гуморальную защиту. В системе комплемента может отсутствовать несколько составляющих.
Нужно знать! Клеточный иммунодефицит характеризуется недостаточностью иммунокомпетентных клеток, к которым относятся лимфоциты, плазмоциты, макрофаги. Гуморальный иммунодефицит означает дисфункцию в выработке антител.
Симптомы первичных иммунодефицитов
На первичные иммунодефициты указывают признаки проявления и симптомы. Изучая клиническую картину протекания болезни, врачи клиники выявляют разновидность иммунной недостаточности. Этому способствует осмотр, анализы, сбор анамнеза для выяснения генетической патологии.
- Первичные дефициты клеточного иммунитета порождают инфекции вирусного и грибкового характера. Характерными признаками считаются повторные простуды, тяжёлое протекание ОРВИ, ветрянки, паротита, частые проявления герпеса. Больной страдает молочницей, воспалением лёгких, органов ЖКТ, обусловленных грибками. Клеточный иммунодефицит способствует повышению риска онкологии, лимфомы.
- Недостаточность гуморальной защиты провоцируют бактериальные заражения. Это пневмонии, гнойники на коже, рожа, стафилококк, стрептококк.
- Недостаточность уровня секреторного иммуноглобулина А вызывает поражение слизистых оболочек во рту, носу, глазах, кишечнике, страдают бронхи.
- Комбинированные ИД характеризуются осложнениями вирусных и бактериальных инфекций. Проявления этой формы первичного иммунодефицита бывают неспецифическими — они выражаются в пороках развития, опухолевых процессах, лимфоидных тканей, вилочковой железы, мегалобластной анемии.
- Врождённая нейтропения и дисфункция фагоцитоза гранулоцитов порождает бактериальные воспалительные процессы с гнойниками, абсцессами. Результатом может быть сепсис.
- Комплемент-ассоциирующие первичные иммунодефициты влекут бактериальные инфекции, аутоиммунные заболевания, а также рецидивирующие отёки на теле, конечностях — наследственный ангионевротический отёк (НАО).
Причины первичных иммунодефицитов
Дисфункции иммунной системы формируются у эмбриона внутри утробы матери. На этот процесс оказывают влияние разные факторы. Пренатальная диагностика показывает сочетание врождённых пороков развития плода с иммунодефицитом. Этиология ПИДС основывается на трёх патологиях.
- Генетические мутации, означающие, что в генах, от которых зависит исполнение иммунокомпетентными клетками своих функций, произошли изменения. То есть нарушается процесс по развитию и дифференцировке клеток. Наследование аномалии идёт по аутосомно-рецессивному типу, когда оба родителя — носители мутагена. Лишь незначительное количество мутаций развивается спонтанно либо герминативным путём ( в половых клетках).
- Тератогенный фактор — это влияние на эмбрион опасных токсинов, приводящих к врождённому первичному иммунодефициту. Провоцируют ИД TORCH-инфекции — цитомегаловирус, герпес, краснуха, токсоплазмоз у беременных.
- Неясной этиологии. Иммунная недостаточность, причина которой не выяснена.
К подобным состояниям относится бессимптомные ИД, которые проявляются инфекционными осложнениями при провокационных ситуациях. Если даже один из элементов защитного механизма подвергается аномалии, то защитные силы ослабевают, пациент становится объектом для вторжения различных инфекций.
Диагностика первичной иммунной недостаточности
Иммунодефицитные состояния идентифицируются по типу, поскольку первичный ИД чаще всего врождённый, то его разновидность определяется в первые месяцы либо недели.
Визит к врачу обязателен при частых болезнях малыша, простудах, развитии грибковых, вирусных, бактериальных инфекций. Аномалии в развитии ребёнка тоже могут зависеть от первичного иммунодефицита.
Чтобы решить проблему необходима срочная диагностика и немедленное начало лечения.
Методика идентификации заболевания включает следующие процедуры:
- общий осмотр, при котором обращают внимание на поражение кожи, слизистых, гнойничковые процессы, подкожные отёки жировой ткани;
- исследование лейкоцитарной формулы по общему анализу крови, об ИД говорит наличие лейкопении, нейтропении, агранулоцитоза, иных нарушений;
- биохимия крови показывает дисгаммаглобулинемию, присутствие нехарактерных метаболитов, свидетельствующих о первичном гуморальном ИД;
- специфическое исследование на реакции иммунной системы. Изучаются показатели активности иммунокомпетентных клеток;
- молекулярно-генетический анализ — метод генного секвенирования на тип мутации. Это способ определения синдромов Брутона, Ди Джорджи, Дункана, Вискотта-Олдрича.
Врач дифференцирует иммунодефицитные состояния с приобретёнными вторичными ИД, возникающие от влияния радиации, токсических веществ, аутоиммунных заболеваний, онкологии. У взрослых диагноз поставить сложно, поскольку признаки сглажены, симптоматика неявная.
Пренатальная диагностика
Определение первичного ИД при помощи биопсии ворсинок хориона называется пренатальной идентификацией формы заболевания. Кроме того изучается культура клеток плодных вод, фетальной крови. Это сложные анализы, которые показаны в тех случаях, когда у родителей выявлен мутаген.
Но для выявления Х-сцепленного тяжелого комбинированного иммунодефицита этот способ даёт точный результат, а также уточняет диагноз при первичных синдромах ИД, хроническом гранулематозе, других состояниях ТКИД.
Лечение первичных иммунодефицитов
Разная этиология и патогенез заболеваний не позволяют выработать общую методику терапии патологии. При тяжёлых формах, терапевтическое лечение не актуально, оно приносит лишь временное облегчение, но летальный исход неизбежен от осложнений иммунодефицитов. В этих случаях помогает только пересадка костного мозга либо эмбриональной субстанции вилочковой железы.
Дефицит клеточного иммунитета компенсируется методикой применения специфических колониестимулирующих препаратов. Это заместительная иммунотерапия тималином, тактивином, левамизолом и другими средствами, выбор которых делает иммунолог. Ферментопатии корректируются энзимами, метаболитами. Распространённым препаратом этого ряда является биотин.
Дисглобулинемии (недостаточность гуморальной защиты) лечат иммуноглобулиновым замещением, в зависимости от недостающих веществ этого вида. Но главным препятствием для прогресса заболевания является профилактика инфекций. Причём вакцинация больных первичным ИД детей не даёт эффекта, она опасна.
Прогноз и профилактика
При тяжёлых первичных ИД ребёнок обречён, он погибает в первый год жизни. Другие патологии иммунной системы излечиваются, как описано выше. Основной задачей родителей является своевременное обращение к врачу и уход за детьми. Нельзя допускать заражения ребёнка вирусными, бактериальными, грибковыми возбудителями.
Если вы планируете рождение ребёнка и у вас есть проблемы генной мутации, то консультация с иммунологом обязательна. Во время беременности нужно пройти пренатальную диагностику, беречься от инфекций и соблюдать все рекомендации доктора.
Для больных ИД важно соблюдать личную гигиену, уход за полостью рта, слизистой носа, глаз осуществлять осторожно, не повреждая их целостность. Необходимы сбалансированное питание, исключение контактов с больными во время эпидемий, медикаментозная профилактика инфекций.
Осложнения после иммунодефицита
Первичные иммунодефициты приводят к грозным осложнениям. Результатом последствий может быть гибель человека. Такими состояниями считаются сепсис, абсцессы, пневмонии, тяжёлые инфекции.
Возможны аутоиммунные заболевания, когда сбой иммунной системы состоит в том, что она уничтожает собственные клетки.
Возрастает риск онкологических заболеваний и дисбаланса ЖКТ, сердечно-сосудистой системы.
Заключение
Первичный иммунодефицит — не всегда приговор. Нужно наблюдаться у иммунолога постоянно, это поможет сохранить удовлетворительное качество жизни и жить долго.
Синдром первичного иммунодефицита: диагностика, лечение, прогноз Ссылка на основную публикацию
Источник: https://BestImmuno.ru/zabolevaniya/sindrom-pervichnogo-immunodefitsita-diagnostika-lechenie-prognoz
Хроническая гранулематозная болезнь
| Хроническая гранулематозная болезнь (ХГБ) – это наследственное (генетическое) заболевание иммунной системы, при котором поражается одна из разновидностей лейкоцитов – нейтрофилы. Их функцией которых является борьба с инфекциями. При ХГБ фагоциты не могут защищать организм от бактериальных и грибковых инфекций. Люди с ХГБ подвержены часто подвержены развитию пневмонии, инфекций легких, кожи, лимфатических узлов, печени, желудочно-кишечного тракта или других инфекций. В очаге воспаления фагоциты формируют скопления, которые называются гранулемами. У большинства людей ХГБ выявляется в детстве, но у некоторых людей она может быть выявлена только во взрослом возрасте. |
| Симптомы болезни обычно появляются в раннем детстве, но могут не проявиться до ранней юности. Возникают хронические инфекционные поражения кожи, легких, лимфатических узлов, ротовой полости, носа и кишечника. Развиваются абсцессы вокруг заднего прохода, в костях и головном мозге. Лимфатические узлы могут увеличиваться и воспаляться, печень и селезенка увеличиваются, у ребенка замедляется рост. |
| Хроническая гранулематозная болезнь – наследственное заболевание с Х-сцепленным и аутосомно-рецессивным типом наследования. При первой форме поражаются только мальчики, при второй – и мальчики, и девочки. В результате дефекта генов возникает первичный иммунодефицит, обусловленный неспособностью нейтрофилов вырабатывать активный кислород, что приводит к неспособности противостоять бактериальной и грибковой инфекции. |
Для диагностики заболевания ваш врач изучит ваш анамнез, в том числе семейный, и проведет общий осмотр. Ваш врач может назначить несколько исследований, чтобы диагностировать ХГБ.
|
Существует несколько различных подходов к лечению ХГБ. Лечение может быть направлено на профилактику инфекций и управление заболеванием. Лечение включает:
|
Когда обратиться к врачу:
Когда вызвать скорую:
|
Источник: https://www.zdorovieinfo.ru/bolezni/hronicheskaya_granulematoznaya_bolezn/
Хроническая гранулематозная болезнь, CYBB м. — узнать цены на анализ и сдать в Москве
Метод определения Секвенирование. Выдаётся заключение врача-генетика!
Исследуемый материал Цельная кровь (с ЭДТА)
Доступен выезд на дом
Исследование мутаций в гене CYBB.
Хроническая гранулематозная болезнь (ХГБ, ОMIM306400) – наследственное заболевание с частотой встречаемости 1:250 000, при котором снижается антимикробная активность фагоцитов.
Первые симптомы у 2/3 больных с ХГБ появляются на первом году жизни в виде инфекций (лимфадениты, пневмонии, параректальные абсцессы, остеомиелиты, септицемия), сопровождающихся лихорадкой, лейкоцитозом, повышением СОЭ. Нередко встречаются дерматиты (иногда с рождения) и осложнения со стороны желудочно-кишечного тракта.
Описаны и более поздние начала клинических проявлений заболевания (даже в возрасте 17-20-и лет). На фоне хронического воспаления у части пациентов с ХГБ происходит образование диффузных гранулём на коже, слизистых, в паренхиматозных органах. Клиническая картина и тяжесть заболевания сильно варьируют.
Процесс прикрепления бактерий и фагоцитоз при хронической гранулематозной болезни протекают нормально, однако захваченные в процессе фагоцитоза микроорганизмы не подвергаются дальнейшему уничтожению. Размножение бактерий подавляется, однако они сохраняют способность выживать внутри клетки, что и поддерживает персистирование инфекционного процесса.
- Тип наследования.
- Х-сцепленный рецессивный.
- Гены, ответственные за развитие заболевания.
Ген CYBB (CYTOCHROME b(-245), BETA SUBUNIT) расположен на хромосоме Х в регионе Хр11.4. Мутации в данном гене обнаруживаются у 60-70% больных ХГБ.
Мутации в данном гене приводят также к развитию семейному Х-сцепленному атипичному микобактериозу.
Патогенез и клиническая картина.
Первые симптомы у 2/3 больных с ХГБ появляются на первом году жизни в виде инфекций (лимфадениты, пневмонии, параректальные абсцессы, остеомиелиты, септицемия), сопровождающихся лихорадкой, лейкоцитозом, повышением СОЭ. Нередко встречаются дерматиты (иногда с рождения) и осложнения со стороны желудочно-кишечного тракта.
Инфицированию подвержены части тела, постоянно контактирующие с бактериями. В областях вокруг носа и рта часто образуются экзематозные очаги, которым сопутствует гнойный аденит, требующий хирургического дренирования. Почти постоянным признаком служит гепатоспленомегалия; очень часто в печени развиваются стафилококковые абсцессы.
Нередко присоединяется остеомиелит, как правило, мелких, а также длинных трубчатых костей.
Описаны и более поздние случаи начала клинических проявлений заболевания (даже в возрасте 17-20-и лет).
На фоне хронического воспаления у части пациентов с ХГБ происходит образование диффузных гранулем на коже, слизистых, в паренхиматозных органах. Клиническая картина и тяжесть заболевания сильно варьируют.
Морфология нейтрофилов и моноцитов не изменяется, специфический гуморальный и клеточный иммунитет остается в норме.
Частота встречаемости: 1:250 000.
Перечень исследуемых мутаций может быть предоставлен по запросу.
- Мамаев Н.Н., Рябов С.И. «Гематология — — Руководство для врачей», 2008 г.
- Cross, A. R., Curnutte, J. T., Rae, J., Heyworth, P. G. Hematologically important mutations: X-linked chronic granulomatous disease. Blood Cells Mol. Dis. 22: 90-95, 1996.
- OMIM.
Источник: https://www.invitro.ru/analizes/for-doctors/1124/7780/
6 различных иммунодефицитных состояний | Первичный иммунодефицит (ПИД) | Справка.Неинвалид.ru
Это генетическое заболевание связано с дефектом фагоцитов, клеток иммунной системы, которые защищают организм путем поглощения (фагоцитоза) вредных чужеродных частиц, бактерий, а также мертвых или погибающих клеток, из-за которого снижается их антимикробная активность.
В результате неспособности фагоцитов уничтожать микроорганизмы пациенты восприимчивы к инфекциям, возбудителями которых являются некоторые бактерии и грибы. Это состояние также связано с чрезмерным скоплением иммунных клеток, называемые гранулемами (от которых происходит название болезни) в местах инфекции и очагах воспаления.
Наиболее частые возбудители инфекций при данной патологии – это золотистый стафиллококк, кишечная палочка, сальмонелла.
Жизнеугрожающей инфекцией при хроническом грануломатозе является аспергиллез, поражающий легкие и другие органы (головной мозг, кости, сердце).
Описаны также аутоиммунные осложнения в виде ювенильного ревматоидного артрита (поражение суставов), гломерулонефрита (поражение почек).
http://ipopi.org/wp-content/uploads/2017/07/1-CGD.pdf
ОВИН — общая вариабельная иммунная недостаточность
Общая вариабельная иммунная недостаточность – нарушение, характеризующееся низкими уровнями иммуноглобулинов (антител) в сыворотке крови и повышенной чувствительностью к инфекциям. В большинстве случаев генетические причины низких уровней иммуноглобулинов сыворотки крови неизвестны.
Эта форма иммунодефицита встречается относительно часто, в связи с чем в ее названии есть слово “общая”. Степень и тип недостаточности иммуноглобулинов в сыворотке крови, а также клиническое течение у разных пациентов различны, что объясняет наличие слова “вариабельная”.
Подозрение на общую вариабельную иммунную недостаточность (ОВИН) возникает при обследовании детей или взрослых с рецидивирующими отитами, синуситами, бронхитами и пневмониями.
http://ipopi.org/wp-content/uploads/2017/07/2-CVID.pdf
Синдром гипериммуноглобулинемии М
У большинства больных с синдромом гипериммуноглобулинемии М (ГИГМ) клинические симптомы развиваются на первом или втором году жизни. Проявляются снижением в крови уровня всех иммуноглобулинов, кроме IgM.
Наиболее часто наблюдается повышенная подверженность инфекциям, в том числе рецидивирующим инфекциям верхних дыхательных путей и бронхов. Чаще всего возбудителями этих инфекций являются бактерии. Кроме того, тяжелые инфекции могут быть вызваны многими другими микроорганизмами.
Также для таких пациентов характерна склонность к развитию аутоиммунных заболеваний.
http://ipopi.org/wp-content/uploads/2017/07/3-Hyper-IGM-S.pdf
ТКИН — тяжелая комбинированная иммунная недостаточность
Тяжелая комбинированная иммунная недостаточность (ТКИН) является редким смертельным синдромом, обусловленным различными генетическими факторами, и сочетающим отсутствие функций Т- и В- лимфоцитов (а во многих случаях также отсутствие функции естественных киллеров или NK-лимфоцитов). Эти нарушения приводят к чрезвычайной чувствительности к тяжелым инфекциям. В настоящее время известны двенадцать генетических причин ТКИН.
Слишком частые инфекции – наиболее характерное проявление ТКИН у детей первого года жизни. Обычно эти инфекции не похожи на инфекции, которыми болеют нормальные дети (например, частые простуды). Инфекции у детей с ТКИН могут протекать гораздо тяжелее и даже угрожать жизни пациента – пневмония, менингит и сепсис.
У детей первого года жизни с ТКИН инфекция возникает при контакте с микроорганизмами, вызывающими инфекции у нормальных детей, а также с микроорганизмами и вакцинами, которые обычно не вредят детям с нормальным иммунитетом. Среди наиболее опасных – микроорганизм Pneumocystis jiroveci, вызывающий пневмонию (пневмоцистную), быстро приводящую к смерти при позднем выявлении и лечении.
Другим очень опасным микроорганизмом является вирус ветрянки. У детей первого года жизни с ТКИН это заболевание может стать смертельным, так как выздоровление не наступает и возможно распространение на легкие, печень и головной мозг.
Цитомегаловирус (ЦМВ), который почти все носят в слюнных железах, может вызвать смертельную пневмонию у детей первого года жизни с ТКИН.
Другими опасными вирусами для детей с ТКИН являются вирус простого герпеса, аденовирус, парагрипп 3, вирус Эпштейна-Барра (ВЭБ или вирус инфекционного мононуклеоза), вирусы полиомиелита, вирус кори и ротавирус.
Вакцины, содержащие живые ослабленные штаммы, у детей с ТКИН могут быть причиной инфицирования при иммунизации, например, вакцина БЦЖ.
http://ipopi.org/wp-content/uploads/2017/07/RUSSO-libretto-SCID.pdf
Синдром Вискотта- Олдрича
Для классической формы синдрома Вискотта-Олдрича характерен комплекс нарушений, в который входят повышенная кровоточивость в связи со снижением числа тромбоцитов, рецидивирующие бактериальные, вирусные и грибковые инфекции, а также кожная экзема.
У детей раннего возраста, подростков и взрослых больных СВО могут развиться злокачественные опухоли. Многие из них поражают В-лимфоциты и становятся причиной лимфомы или лейкоза.
http://ipopi.org/wp-content/uploads/2017/07/5-WAS.pdf
X-сцепленная агаммаглобулинемия
Больные Х-сцепленной агаммаглобулинемией (Х-СА) подвержены инфекциям в связи с недостатком антител. Эти инфекции часто поражают слизистые оболочки, поэтому у пациентов развиваются отиты, риниты, бронхиты и пневмонии.
У пациентов с Х-СА инфекции обычно вызываются микроорганизмами, которые очень быстро уничтожаются или инактивируются антителами у здоровых людей.
Возбудителями таких инфекций чаще всего являются пневмококк, стрептококк, стафилококк или Haemophilus influenzae. Некоторые особые виды вирусов также могут стать причиной тяжелой инфекции у этих пациентов.
При физикальном обследовании у большинства больных с Х-СА обнаруживают очень маленькие миндалины и лимфатические узлы (шейные железы).
http://ipopi.org/wp-content/uploads/2017/07/6-XLA.pdf
Источник: http://spravka.neinvalid.ru/zabolevaniya/pervichnyj-immunodefitsit-pid/6-razlichnyh-immunodefitsitnyh-sostoyanij/
Хроническая гранулематозная болезнь
_Elena_
Иммунодефицит
Доброго времени суток
Есть ли детки с иммунодефицитами?
Может быть есть астматики, которые сдавали иммунограмму?
Ситуация: у сына (помимо других проблем) клиника иммунодефицита: афтозный рецидивирующий стоматит, гингивиты, отиты, бронхиты, уретриты..
…. Читать далее →
_Elena_
Иммунодефицит
Доброго времени суток Есть ли детки с иммунодефицитами?
Может быть есть астматики, которые сдавали иммунограмму?
Ситуация: у сына (помимо других проблем) клиника иммунодефицита: афтозный рецидивирующий стоматит, гингивиты, отиты, бронхиты, уретриты..
Имму….. Читать далее →
Ксения
Друзья! Нас просят о помощи!
Здравствуйте!
Пожалуйста, откликнитесь на призыв о помощи маленького голубоглазого мальчика Назарчика Цыценко! Малышу всего 2 года, но его жизнь в смертельной опасности! У Назарчика совсем нет иммунитета! Страшное и редкое заболевание — Первичный иммунодефицит, хроническая гранулематозная болезнь — заточила ребенка в четыре стены (ему опасно буквально все от общения с детьми до воды из под крана). Ежедневный прием лекарств не лечит,а лишь помогает предупредить возможные инфекции. Спасти Назарчика сможет только дорогостоящая трансплантация костного мозга и как можно скорее! Родители в… Читать далее →
Наталия
Один из миллиона, но от этого не легче!
Приветствую вас, дорогие форумчанки!
Ваша помощь необходима полугодовалому Ярославскому Андрюше (12.12.2013) г.Запорожье, Украина.
У него редчайшее генетическое заболевание — Первичный иммунодефицит Хроническая гранулематозная болезнь.
Группа помощи: https://vk.com/club70163203
—————————————-
Открыт сбор на трансплантацию костного мозга в Германии.Сумма к сбору: 550000 евро!
—————————————- Читать далее →
Календарь развития ребенка
Мы расскажем вам реальные истории наших мамочек, которые прошли через это или проходят прямо сейчас!
❀ Анастасия ❀
Прививка против туберкулёза (БЦЖ)
Из письма врача-фтизиатра в Комитет по биоэтике Российской Академии Наук
Я врач — фтизиатр с 30-летним стажем практической работы. Впервые мысли об отрицательном влиянии вакцины БЦЖ на организм новорождённых возникли у меня в 60-70-е годы. Тогда стали появляться чаще, чем было до 1962 г.
, случаи развития левосторонних подмышечных лимфаденитов, обусловленных вакциной БЦЖ. Как известно, в 1962 г. введена внутрикожная вакцинация БЦЖ. После этого появились дети раннего возраста, больные хронической гранулематозной болезнью (ХГБ), у которых обязательно имел место левосторонний подмышечный лимфаденит-БЦЖ…
Читать далее →
Ирина
Поможем Юрочке вместе!
Нет в мире прекраснее чувства, чем ощущение, что ты сделал людям хоть каплю добра. Л. Н.
Толстой Здравствуйте, дорогие друзья! Я, Ирина Коваленко, обращаюсь к вам с просьбой о помощи в спасении моего любимого сына Юры Коваленко! Наш сын, второй ребенок родился 16 декабря 2004 года в срок.
Роды прошли успешно, но уже в этот момент стало понятно, что что-то не так. Ребенок родился с везикулопустулезом (множественными гнойничками по всему телу). Практически сразу после родов у Юры начались серьезные проблемы… Читать далее →
«Благотворительный Проект «Жизнь»»
Обсудите вашу тему в сообществе, узнайте мнение активных пользователей Бэбиблога
Перейти в сообщество
Александра
Маленький принц — Мишенька Махов, vk.com/mmishastik очень ждёт помощи взрослых, неравнодушных к суд
Малышу всего 1 годик, но сразу после рождения Мишутку настигла БЕДА…
На данный момент уже идёт обследование в Швейцарской клинике Цюриха University Children's Hospital Zurich, но в ближайшее время будет выставлен счёт на лечение, он обещает быть очень большим, поэтому нужно успеть погасить задолженность за обследование, которая на данный момент составляет 264 987 рублей! Беда подошла незаметно и забрала самое дорогое — здоровье, а вместе с ним и счастливое беззаботное детство… Мише был поставлен очень редкий диагноз — Первичное иммунодефицитное… Читать далее →
Александра
SOS!!!!!!!!!! ОСТАЛОСЬ СОБРАТЬ 398 877 руб. ЗА 4 ДНЯ!!!!! Мы должны успеть,ведь на кону стоит ЖИЗНЬ
Маленький герой — Мишенька Махов, vk.com/mmishastik Малышу всего 1 годик, но сразу после рождения Мишутку настигла БЕДА… Она подошла незаметно и забрала самое дорогое — здоровье, а вместе с ним и счастливое беззаботное детство…
Мише был поставлен очень редкий диагноз — Первичное иммунодефицитное состояние (ПИД), дефект фагоцитоза: хроническая гранулематозная болезнь (ХГБ).
Суть заболевания такова, что нейтрофилы могут распознать бактерию, проглотить, а переварить её не могут, в следствии этого по всему тельцу малыша появляются гранулёмы — нарывы, при этом же происходит поражение… Читать далее →
Офф.документ
О том,чтоб реакции организма на эксперименты с ним были обязательно зафиксированы.
Я комменты отключу,пожалуй)Ибо дзен,сами понимаете;)
http://www.bestpravo.ru/federalnoje/bz-zakony/n0g.htmВсе,что описано ниже,официально признано последствием прививок,и никак иначе.Что бы Вам не пытались говорить о «нормальности» 3-4-часового ора,-это лишь попытка оправдаться… Читать далее →
Александра
Маленький герой — Мишенька Махов, vk.com/mmishastik
Малышу всего 1 годик, но сразу после рождения Мишутку настигла БЕДА…
Она подошла незаметно и забрала самое дорогое — здоровье, а вместе с ним и счастливое беззаботное детство… Мише был поставлен очень редкий диагноз — Первичное иммунодефицитное состояние (ПИД), дефект фагоцитоза: хроническая гранулематозная болезнь (ХГБ).
Суть заболевания такова, что нейтрофилы могут распознать бактерию, проглотить, а переварить её не могут, в следствии этого по всему тельцу малыша появляются гранулёмы — нарывы, при этом же происходит поражение внутренних органов , что называют… Читать далее →
Valentinka
Поствакциональные осложнения
Источник: https://www.BabyBlog.ru/theme/hronicheskaya-granulematoznaya-bolezn
Первичный иммунодефицит. Хроническая гранулематозная болезнь
Хроническая гранулематозная болезнь (ХГБ) – генетическое заболевание, связанное с дефектом фагоцитов, клеток иммунной системы, которые защищают организм путем поглощения (фагоцитоза) вредных чужеродных частиц, бактерий, а также мертвых или погибающих клеток, из-за которого снижается их антимикробная активность.
В результате неспособности фагоцитов уничтожать микроорганизмы пациенты с ХГБ восприимчивы к инфекциям, возбудителями которых являются некоторые бактерии и грибы.
Это состояние также связано с чрезмерным скоплением иммунных клеток, называемые гранулемами (от которых происходит название болезни) в местах инфекции и очагах воспаления.
Термин “фагоциты” (от греческого слова “фагос” — пожиратель) применяется для обозначения любой белой клетки крови, которая может обволакивать и поглощать микроорганизмы мельчайшими складками своих мембран.
Эти складки мембраны (называемые также фагосомами) заполнены переваривающими ферментами и другими противомикробными веществами. В крови имеются две основные категории фагоцитов — нейтрофилы и моноциты.
Нейтрофилы (также называемые гранулоцитами) составляют 50-70% всех циркулирующих белых кровяных клеток и первыми отвечают на бактериальную или грибковую инфекцию. Нейтрофилы живут недолго — примерно три дня в тканях после того, как они уничтожат микроорганизмы. Моноциты — второй вид фагоцитов, составляют 1-5% циркулирующих белых клеток крови. Попадающие в ткани моноциты могут там находиться длительное время, медленно трансформируясь в клетки, называемые макрофагами или дендритными клетками, которые помогают справляться с инфекциями.
Фагоциты внешне очень похожи на амеб, так как легко изменяютсвою форму и выбираются из кровеносных сосудов в ткани, легко проскальзывая между другими клетками. Они могут чувствовать присутствие патогенных бактерий или грибов, вызывающих инфекцию в тканях, и поэтому быстро передвигаются к очагам инфекции.
Попавшие в очаг инфекции фагоциты приближаются к микроорганизмам и пытаются охватить их и удержать в выступе мембраны, который образует некоторое подобие пузырька или мембранного мешка, называемого фагосомой, внутри клетки. После этого клетка начинает выделять в фагосому порции переваривающих ферментов и других противомикробных веществ.
Клетка также вырабатывает перекись водорода и другие токсические окислители, которые непосредственно выделяются в фагосому. Перекись водорода вместе с другими веществами способствует уничтожению и перевариванию микроорганизмов — возбудителей инфекции.
Фагоциты у больных ХГБ могут нормально мигрировать в очаги инфекции, поглощать микробы-возбудители инфекции и даже выделять в фагосомы переваривающие ферменты и другие противомикробные вещества, однако у них отсутствует механизм продукции перекиси водорода идругих окислителей.
Поэтому фагоциты больных ХГБ могут защитить организм от некоторых видов инфекции, но не от инфекций, для борьбы с которыми совершенно необходима перекись водорода. Этот дефект защиты от инфекций относится только к некоторым бактериям и грибам.
У больных ХГБ имеется нормальный иммунитет к большинству вирусов и некоторым видам бактерий и грибов. Вот почему больные ХГБ не являются постоянно инфицированными.
Они могут жить много месяцев или даже лет без инфекций, а потом заболеть тяжелым или угрожающим жизни инфекционным заболеванием, возбудитель которого не может быть обезврежен без перекиси водорода.
Больные ХГБ вырабатывают нормальные количества антител обычных типов, в связи с чем они, в отличие от больных с врожденными дефектами функций лимфоцитов, не обладают высокой чувствительностью к вирусам.
КЛИНИЧЕСКИЕ ПРОЯВЛЕНИЯВ большинстве случаев ХГБ проявляется уже на первом году жизни. После введения вакцины БЦЖ, развивается микобактериальное поражение регионарных лимфоузлов, а при распространении инфекции – поражение легких и других органов.
Пациенты с данным диагнозом страдают тяжелыми повторными бактериальными и грибковыми инфекциями.
Наиболее частые проявления:поражение легких – повторные пневмонии, поражение внутригрудных лимфоузлов, абсцессы легких, гнойные плевриты; кожные абсцессы (гнойники) и лимфадениты; абсцессы, локализующиеся в брюшной полости (под диафрагмой или печеночные);остеомиелиты (гнойное поражение кости), сепсис (заражение крови). На фоне инфекций развиваются гранулемы, закрывающие просвет полых органов (пищевода, желудка, мочеточника, мочевого пузыря), что может проявляться соответственно рвотой или задержкой мочи с болевым синдромом.
Дети, страдающие от хронических инфекций, отстают в физическом развитии.
Наиболее частые возбудители инфекций при данной патологии –это золотистый стафиллококк, кишечная палочка, сальмонелла.
Жизнеугрожающей инфекцией при хроническом грануломатозе является аспергиллез, поражающий легкие и другие органы (головной мозг, кости, сердце).
Описаны также аутоиммунные осложнения в виде ювенильного ревматоидного артрита (поражение суставов), гломерулонефрита (поражение почек).
ДИАГНОЗПоскольку наиболее частая генетическая форма ХГБ встречается только у мальчиков, возникает ошибочное мнение, что ХГБ не может поражать девочек. Существуют некоторые генетические формы ХГБ, которые бывают и у девочек. Девочки составляют примерно 15% от числабольных ХГБ.
Тяжесть ХГБ может быть разной, и возникновение инфекции у каждого больного ХГБ в некоторой степени определяется случайностью. Поэтому у некоторых больных ХГБ не возникает никаких инфекций, которые бы привлекли внимание к их заболеванию, до позднего подросткового или даже взрослого возраста.
Хотя инфекции, которые становятся причиной выявления этого заболевания, чаще всего наблюдаются в раннем детстве, средний возраст выявления ХГБ у мальчиков составляет примерно три года, а у девочек семь лет.
Для педиатров и терапевтов, оказывающих помощь подросткам и молодым взрослым людям, важно никогда не исключать возможности диагноза ХГБ у молодого взрослого человека с пневмонией, вызванной необычным микроорганизмом, например, грибом Aspergillus.
Пациент любого возраста с пневмонией, вызванной Aspergillus, Nocardia или Burkholderia cepacia, стафилококковым абсцессом печени, стафилококковой пневмонией, инфекционным поражением кости микроорганизмом Serratia marcescens, должен быть обследован на ХГБ. Самым точным методом выявления ХГБ является измерение выработки перекиси водорода фагоцитами.
Перекись водорода, выделяемая нормальными фагоцитами, окисляет химическое вещество дигидрородамин, вызывая его флуоресценцию, которая измеряется сложными приборами. В отличие от этого, фагоциты больных ХГБ не могут вырабатывать достаточных количеств перекиси водорода для флуоресценции дигидрородамина.
Кроме того, для диагностики ХГБ еще используются и другие тесты, например, тест гистохимического восстановления нитросинего тетразолия (НСТ). Тест НСТ оценивают визуально: фагоциты, вырабатывающие окисляющие вещества, становятся синими, и их вручную подсчитывают под микроскопом. Этот тест более подвержен субъективной оценке человека и можетдать ложно-отрицательные результаты, в результате чего остаютсяневыявленными легкие формы ХГБ, когда клетки слегка синеют, но не достигают нормального цвета. После постановки диагноза ХГБ следует обратиться в одну из немногих специализированных лабораторий, где могут подтвердить генетический тип.
ТИП НАСЛЕДОВАНИЯХроническая гранулематозная болезнь (ХГБ) является генетическим заболеванием, которое может пердаваться по наследству.
Существуют два типа передачи заболевания: в 75% случаев ХГБ наследуется как сцепленный с полом (Х-хромосомой) рецессивный признак, три другие формы этого заболевания наследуются как аутосомно рецессивные признаки.
Тип наследования важен для определения риска развития заболевания у следующих детей.
ЛЕЧЕНИЕПри развитии инфекционных осложнений важно как можно более раннее назначение в/в терапии антибиотиками и противогрибковыми препаратами. При лечении больных ХГБ отмечена эффективность применения гамма-интерферона.
При возникновении поверхностных абсцессов прибегают к хирургическому их лечению (преимущественно пункционному дренированию). Трансплантация костного мозга может быть успешна у пациентов раннего возраста.
Есть сообщения об успешном проведении генной терапии и полном излечении от данного заболевания.
МЕРЫ ПРЕДОСТОРОЖНОСТИМногие врачи советуют пациентам плавать только в хорошо хлорированных бассейнах.
Плавание в открытой воде, особенно в пресноводных озерах, может привести к контакту с микроорганизмами, не являющимися вирулентными (способными вызвать инфекцию) у здоровых пловцов, но способных вызвать инфекцию у больных ХГБ.
Большую опасность для больных представляет работа с садовым перегноем, после которой может возникнутьтяжелая и угрожающая жизни острая ингаляционная аспергиллезная пневмония. Они также должны избегать контакта с пылью.
ПРОГНОЗЗа последние 20 лет качество жизни многих больных ХГБ значительно улучшилось. Подавляющее большинство детей с ХГБ имеют хорошие шансы дожить до взрослого возраста, а многие взрослые сегодня не только имеют хорошую работу, но и здоровых детей.
Источник: https://www.fondpodsolnuh.ru/disease/article.xl?id=6864