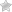Миелобластный лейкоз нередко относят к такой категории, как болезни молодых. По статистике чаще всего он определяется у людей, которые едва перешагнули рубеж в 30-40 лет. Если же говорить о распространенности патологии, то подобное заболевание встречается в 1 случае на 100 тысяч населения. Никакой зависимости от пола или расы не существует.
В чем суть проблемы?
На картинке можно увидеть, какой состав крови у здорового человека, и как она меняется при лейкозе:
Многих, естественно, волнует вопрос: что это такое? Острый миелолейкоз (или резко миелоцитарный лейкоз) – это патология онкологического характера, затрагивающая систему крови, когда отмечается неконтролируемое размножение лейкоцитов измененной формы. Кроме того, в анализе крови будут присутствовать и такие проблемы, как уменьшение количества эритроцитов, тромбоцитов и лейкоцитов из категории нормальных.
Заболевания крови отличаются особой опасностью для человека. И это неспроста, ведь именно кровь находится в тесном контакте со всеми органами и системами в организме, именно она является переносчиком жизненно важного гемоглобина и кислорода. Поэтому крайне важно, чтобы кровообращение было налажено полностью и правильно. Клеточный же состав должен оставаться в пределах нормы.
Под острым миелобластным лейкозом (ОМЛ) понимают состояние, когда изменяются незрелые клетки крови, названные бластами. В это же время в организме ощущается недостаток зрелых клеток. Измененные бласты увеличиваются фактически в геометрической прогрессии.
Тут важно понимать, что процесс изменения клеток необратим и не контролируется никакими лекарственными препаратами. Лейкемия бластных клеток – тяжелое и угрожающее жизни заболевание.
Обычно все патпроцессы в такой ситуации локализуются в костном мозге и периферической системе кровообращения. Злокачественные клетки активно подавляют не сломанные и не испорченные и начинают заражать буквально все в теле.
Что такое лейкоз и можно ли его предотвратить? Что такое химиотерапия? Ответы на вопросы узнаете, посмотрев следующее видео:
Виды проблемы
Острый миелобластный лейкоз – это достаточно широкая группа патологических изменений в организме человека. Так, выделяют несколько вариантов при классификации данной патологии:
- М0 – опасная разновидность, которая отличается высокой сопротивляемостью к химиотерапии и имеет крайне неблагоприятные прогнозы для жизни пациента.
- М1 – быстропрогрессирующий вид миелобластного лейкоза с высоким содержанием в крови бластных клеток.
- М2 – уровень зрелых лейкоцитов около 20%.
- М3 (промиелоцитарный лейкоз) – отличается активным скоплением незрелых лейкоцитов в костном мозге.
- М4 (миеломоноцитарный лейкоз) – лечится химиопрепаратами и пересадкой костного мозга. Чаще диагностируется у детей и имеет неблагоприятные прогнозы для жизни.
- М5 (монобластный лейкоз) – в костном мозге определяется около 25% бластных клеток;
- М6 (эритроидный лейкоз) – редко встречается, имеет неблагоприятные прогнозы.
- М7 (мегакариобластный лейкоз) — патология с травмированием миелоидного ростка, развивающаяся при синдроме Дауна;
- М8 (базофильный лейкоз) – диагностируется у детей и подростков. Вместе с миелобастными клетками определяются атипичные базофилы.
Более подробная классификация лейкозов представлена на картинке:
Выбор тактики терапии, постановка прогнозов жизни и длительность ремиссионных промежутков напрямую зависят от вида лейкоза.
Причины развития проблемы
Белокровие, острый миелоидный лейкоз – все это одно и то же название такой патологии. Естественно, что многих волнует, что приводит к развитию такой проблемы. Но, как и в случае с другими видами онкологии, врачи со 100% уверенностью не могут назвать катализатор изменения клеток крови. Однако возможность выделить предрасполагающие факторы есть.
На сегодняшний день основной причинойразвития патологии называют хромосомные нарушения. Обычно имеют в виду ту ситуацию, которая названа «филадельфийская хромосома».
Это состояние, когда из-за нарушения начинают меняться местами целые участки хромосом, образуя совершенно новую структуру молекулы ДНК.
Дальше быстро образуются копии таких злокачественных клеток, что и приводит к распространению патологии.
К такой ситуации, по мнению медиков, могут приводить:
- Облучение радиацией. Так, например, в зоне риска те, кто находится на производственных участках с большим количеством излучения, спасатели, работающие на месте разбора завалов, как это было на Чернобыльской АЭС, пациенты, проходившие ранее облучение для терапии иного вида онкологии.
- Некоторые вирусные заболевания.
- Электромагнитные излучения.
- Воздействие ряда лекарственных средств. Обычно в этом случае имеют в виду терапию против рака из-за ее повышенной токсичности на организм.
- Наследственность.
Те, кто в группе риска, обязательно должны регулярно проходить обследование.
Симптоматика патологии
ОМЛ у взрослых, как и у детей, характеризуется определенными симптомами и признаками. Клетки размножаются и изменяются с неконтролируемой скоростью, поэтому признаки заболевания появляются довольно быстро, и игнорировать их у человека никак не получится – слишком они яркие.
https://www.youtube.com/watch?v=9L2fgTdUUSg
В числе симптомов данной патологии выделяют:
- Бледность кожных покровов – такой симптом нередко называют одним из первых и характерных, т.к. он сопровождает все патологии кроветворения.
- Признаки анемии.
- Бесконтрольные кровотечения, которые иногда трудно остановить.
- Появление субфебрильной температуры – она может колебаться в пределах 37,1-38 градусов, появление потливости во время ночного сна.
- Появление сыпи на коже – она представляет собой небольшие красные пятнышки, которые при этом не зудят.
- Появление одышки – причем она характерна даже для небольших физнагрузок.
- Появление чувства боли в костях, особенно активизирующееся во время ходьбы, но боль несильная, поэтому люди могут привыкнуть к ней.
- Появление не деснах припухлости, развитие кровоточивости и гингивита.
- Появление гематом – такие пятна красно-синего цвета могут появляться в любой части тела.
- Снижение иммунитета и частые инфекционные болезни.
- Резкая потеря веса.
- Какие определены нормы показателей крови для здорового человека, смотрите на картинке:
- Вторая часть таблицы на следующей картинке:
Возраст пациента при этом не важен. У всех эти признаки при наличии данного заболевания будут появляться. Если интоксикация затронула головной мозг, появляются неврологические симптомы: головные боли, эпиактивность, рвота, ВЧД, нарушения слуха, зрения.
У детей могут проявляться следующие признаки:
- Ухудшение памяти;
- Апатия и нежелание играть;
- Боли в животе;
- Изменения походки.
Как диагностировать?
Так как резко ОМЛпроявляется всегда, то с походом к врачу затянуть не удастся. На приеме специалист предложит целый комплекс мероприятий, которые позволят поставить точный диагноз и подобрать оптимальные методы лечения. Сначала осмотр и опрос. Затем предполагаются следующие диагностические процедуры:
- Анализ крови общего плана. Тут будут обращать особое внимание на количество лейкоцитов в крови. В крови больных увеличивается число незрелых белых клеток, отмечается изменение числа тромбоцитов. Исследование анализа крови – одно из основных в этом списке.
- Биохимический анализ крови. Такой анализ при лейкозе покажет высокое содержание витамина В12, а также мочевой кислоты и ряда ферментов.
- Биопсия костного мозга.
- Цитохимия – для изучения берут образцы крови и костного мозга.
- УЗИ – такой метод помогает определить увеличение в размерах печени и селезенки (эти органы обычно увеличиваются при данной патологии).
- Исследование генетики.
На основании полученных данных врач сможет поставить точный диагноз и определить направление терапии.
Как лечить?
Медицинские манипуляции подразумевают следующие варианты:
- Химиотерапия;
- Лучевая терапия;
- При необходимости — пересадка костного мозга, а также стволовых клеток (берут материал от донора);
- Лейкаферез – процедура, когда извлекают измененные клетки;
- Удаление селезенки.
Однако в большинстве случаев вылечить заболевание сложно и даже невозможно. Поэтому терапия является более симптоматической. С ее помощью облегчают состояние больного и поддерживают его жизненные функции.
Посмотрите репортаж о новом методе лечения лейкоза у детей:
Прогноз для жизни
Стоит понимать, что на разных стадиях заболевания при онкологии обычно бывают разные прогнозы. Кроме того, прогноз для жизни зависит от типа заболевания, возраста пациента, резистентности к химиотерапевтическим препаратам. При обнаружении заболевания на ранних этапах выживаемость близка к 90%.
Прогноз жизни при белокровии (остром миелоидном лейкозе), обнаруженном на 2-3 стадии, составляет 5 лет с учетом успешного лечения. Около 70% пациентов могут прожить данный срок, при этом в 35% случаев возникают рецидивы. У детей выживаемость выше примерно на 15-20%.
Прогноз у пациентов с промиелоцитарным лейкозом самый благоприятный. После постановки диагноза и проведенного лечения 70% взрослых живут 10-12 лет.
При осложнениях ОМЛ у взрослых рецидивы случаются в 80% случаев, а вероятность прожить 5 лет снижается до 10-15%.
Загрузка…
Источник: https://OncoVed.ru/krov/ostryj-mieloblastnyj-lejkoz
Острый миелобластный лейкоз: диагностика, лечение, прогноз
Лейкозы, или, говоря языком медицины, гемобластозы – это злокачественные опухоли, происходящие из кроветворных клеток.
В зависимости от того, возник ли лейкемический клон из бластных (молодых) клеток крови, или зрелых их форм, лейкозы могут быть острыми и хроническими.
Острый миелобластный лейкоз составляет 20% всех случаев детских гемобластозов. Среди взрослых заболеваемость резко возрастает после 60 лет.
Общая характеристика
Предшественники клеток крови делятся на 2 большие группы – лимфоцитарный и миелоцитарный росток. Лимфоцитарный росток создает лимфоциты: клетки, «ответственные» за реакции иммунитета. Миелоцитарный росток развивается (дифференцируется) в эритроциты, тромбоциты, нейтрофильные лейкоциты и гранулоциты. Незрелые клетки крови называются бластными.
Таким образом, острый миелобластный лейкоз – это опухоль, возникшая из незрелых клеток миелоцитарного ростка кроветворения.
Диагноз считается установленным, если в анализе костного мозга (миелограмме) оказывается более 20% бластных клеток.
Причины и механизмы развития
Острый миелоидный лейкоз (ОМЛ), как любые лейкозы, возникает из одной мутировавшей клетки, которая теряет способность созревать и начинает бесконтрольно размножаться. Сказать точно, какие именно из известных канцерогенных факторов спровоцировали мутации в каждом конкретном случае обычно невозможно, особенно если речь идет о детях. В целом это могут быть:
- Биологические факторы: онкогенные вирусы, самый известный из которых – Эпштейн-Бара.
- Химические вещества. Всего известно более полутора тысяч канцерогенных соединений. К ним относятся: продукты неполного сгорания табака; вещества, возникающие при неполном окислении жиров (жарение во фритюре); производственные «вредности», появляющиеся при термической обработки нефти, смол, угля; продукты жизнедеятельности плесеней; лекарства, применяемые для химиотерапии злокачественных опухолей (как ни печально, известны случаи, когда лейкоз возникает через 10-20 лет после успешного избавления от рака).
- Физические факторы. В основном это ионизирующее или рентгеновское излучение: известно, что для работников ренгтгенкабинетов вероятность заболеть выше, чем в среднем по популяции.
Кроме внешних воздействий имеет значение наследственность: известен, например «лейкоз близнецов», или передающийся в семье из поколения в поколение. Наследуется не сама болезнь, но генные или хромосомные мутации, повышающие ее вероятность. Помимо этого, некоторые врожденные патологии сочетаются с большей частотой развития лейкозов, в частности, миелолейкоза:
- синдром Дауна;
- нейрофиброматоз 2 типа;
- анемия Фалькони;
- тяжелая врожденная анемия;
- врожденная тромбоцитопения или тромбоцитопатия.
В основе патогенеза, или механизма развития, миелобластного лейкоза – конкуренция между нормальными и опухолевыми клетками. Первоначально одна-единственная атипичная клетка за 3 месяца она способна породить 1012 – один триллион – дочерних бластов, общей массой более килограмма.
Злокачественные клетки дольше живут, так как у них отключается механизм «старения» и естественной гибели. Они вырабатывают вещества, угнетающие активность здоровых элементов крови, подавляющие ростовые факторы.
В такой ситуации возможности нормального кроветворения постепенно истощаются.
Кроме того, организм, «видя» огромное количество миелобластов в костном мозге, сосудистом русле, начинает замедлять активность кроветворения: поскольку все клетки так или иначе дифференцируются из бластных, он воспринимает дегенеративные, злокачественный клетки как «нормальные». Это еще один механизм, позволяющей онкологии выиграть конкуренцию. По мере развития гемобластоза, злокачественные клетки начинают размножаться в других тканях и органах: печени, селезенке, лимфоузлах, коже и даже мозговых оболочках.
Именно замена здоровых клеток крови на массу бластов, неспособных выполнять их функции в силу незрелости, формирует симптомы белокровия.
Клиническая картина
Проявления острого миелолейкоза неспецифичны – это значит, что на начальном этапе симптомы напоминают признаки других заболеваний.
Анемический синдром
Из-за недостаточности кроветворения уменьшается количество эритроцитов.
Общая слабость, бледность, ломкость ногтей и выпадение волос обычно либо не привлекают внимания пациента или его родственников, либо связываются с другими проблемами.
По мере развития болезни слабость нарастает появляется одышка даже при минимальных нагрузках, дети перестают играть в подвижные игры (вообще, снижение активности ребенка – повод внимательно присмотреться к его здоровью).
Геморрагический синдром
В крови становится мало не только эритроцитов, но и тромбоцитов. Нарушается свертываемость крови. Возникают кровотечения различной интенсивности: от точечных подкожных кровоизлияний до обильных внутриполостных (желудочно-кишечных, маточных и т.д.).
Инфекционный и интоксикационный синдромы
Гранулоцитарные лейкоциты, принадлежащие к миелодиному ростку – это клетки, чья функция – защищать организм от микробов. Они содержат множество белков – естественных антибиотиков, перекисей, других веществ, направленных на уничтожение инфекционного агента.
Угнетение кроветворного ростка затрагивает и их, нарушая способность организма бороться с болезнетворными микробами. Это проявляется различными гнойными воспалениями: кожными абсцессами, флегмонами, вплоть до сепсиса. Любое воспаление вызывает интоксикацию – отравление продуктами обмена веществ патогенных микроорганизмов.
Интоксикационный синдром проявляется такими признаками как:
- слабость;
- повышение температуры;
- потливость;
- потеря аппетита, снижение веса;
- неопределенные боли в мышцах.
Гиперпластический синдром
Отмечается у 30-50% пациентов. Опухолевые клетки заполняют не только костный мозг, но и лимфоузлы, печень, селезенку.
Органы увеличиваются, оставаясь безболезненными, их консистенция становится тестообразной.
Сама по себе гиперплазия не опасна, но если разрастаются лимфоузлы, которые находятся в замкнутом пространстве (например, полости средостения, где расположено сердце) они могут сдавить жизненно важные органы.
Нейролейкоз
У 5-10% детей лейкозные клетки создают «метастазы» — участки размножения опухолей в полости черепа, мозговых оболочках, крупных нервах. В результате возникают признаки поражения этих органов: нарушение чувствительности и функции конечностей при инфильтрации периферических нервов, симптомы менингита и опухоли мозга при разрастании инфильтрата внутри полости черепа.
Лейкозные клетки могут образовывать участки экстрамедуллярных (в дословном переводе – расположенных вне костного мозга) опухолей в костях, на коже и слизистых, молочных железах, матке и придатках, простате, легких. При этом возникают симптомы, характерные для патологии этих органов.
Диагностика
Основным признаком лейкоза в анализах крови считается так называемый лейкемический провал: когда в анализе видны множество бластов, мало зрелых клеток и полностью отсутствуют переходные формы.
Но на практике, как отмечается в клинических рекомендациях, на ранних стадиях болезни лейкозных клеток в гемограмме (анализе крови) может и не быть.
Главное основание для постановки диагноза острого миелобластного лейкоза – более 20% бластов в миелограмме (анализе пунктата костного мозга).
Теоретически диагностика должна включать в себя и цитогенетические тесты, когда изучаются конкретные мутации генов, вызвавшие лейкоз.
Это один из важнейших прогностических факторов и современная классификация ВОЗ включает в себя описание более десяти геннных аномалий которые напрямую влияют на прогноз.
К сожалению, в России цитохимию, цитогенетические, молекулярно-генетические и другие подобного рода исследования можно сделать только в крупных центрах.
Лечение: общие принципы
В период полихимиотерапии – лечения, направленного на гибель лейкозного клона, пациенту требуется госпитализация и особый уход: условия, близкие к стерильности. Питание должно быть полноценным, с высоким содержанием белка. Вся пища обязательно подвергается температурной обработке.
Помимо химиотерапии, направленной на причину болезни, при лейкозе обязательно проводят и поддерживающую терапию. Она нужна для того, чтобы лечить и корректировать основные синдромы болезни: при анемии переливают эритроцитарную масса, при геморрагиях – тромбоциты, инфекции лечат антибиотиками и так далее. Поддерживающее лечение бывает нужно и для профилактики осложнений химиотерапии.
Подходы к лечению детей и взрослых отличаются.
Лечение и прогноз: дети
В детском возрасте стандарт – интенсивная полихимиотерапия, дополненная трансплантацией костного мозга.
Сначала нужно вызвать ремиссию. Для этого используют комбинацию из 5 препаратов которые вводят по определенной схеме. После того, как бластных клеток в костном мозге станет меньше 5%, переходят на поддерживающую терапию: до 4 курсов цитостатического препарата.
Далее если есть возможность, делается пересадка костного мозга (за исключением пациентов из группы благоприятного прогноза). Но возможность трансплантации зависит от того, найдется ли подходящий донор.
На практике это означает, что если его не окажется среди близких родственников, возможность трансплантации стремится у нулю: регистр доноров костного мозга в России составляется, но пока даже пройти типирование можно далеко не во всех крупных городах.
Принадлежность к группе благоприятного, промежуточного и неблагоприятного прогноза зависит от генотипических характеристик лейкоза. Кроме того, имеет значение индивидуальная реакция пациента на терапию: если через 2 недели после ее начала количество бластов в костном мозге снижается до 5-15%, вероятность благоприятного исхода резко возрастает.
Если ремиссия продолжается дольше 5 лет, лейкоз считается излеченным. Но возможны и рецидивы. Цикл рецидив-ремиссия может продолжаться либо до стабилизации состояния, либо до полного истощения ресурсов кроветворения – в этом случае прогноз неблагоприятен.
При рецидиве полихимиотерапию проводят в 3 этапа: индукция ремиссии, консолидация ремиссии и курс поддерживающей терапии.
В общих чертах прогноз выживаемости можно описать с помощью таблицы:
| Достижение ремиссии, % | Вероятность общей выживаемости в ближайшие 4 года, % | Вероятность безрецидивной выживаемости в ближайшие 4 года, % | |
| Все пациенты | 90 | 67 | 61 |
| Группа стандартного риска | 91 | 78 | 71 |
| Группа высокого риска | 87 | 55 | 46 |
Как видно, излечить острый миелоидный лейкоз у детей в принципе возможно.
Лечение и прогноз: взрослые
Факторы, влияющие на прогноз у взрослых пациентов, можно разделить на 3 группы:
- Индивидуальные особенности организма и состояния здоровья;
- Биологические характеристики лейкемического клона;
- Правильный подбор метода лечения.
Индивидуальные особенности
Как сам лейкоз, так и его лечение – огромная нагрузка на организм. Поэтому чем старше пациент, тем хуже прогноз. Во-первых, с возрастом хронических патология становится все больше, и протекают они тяжелее. И даже относительно здоровые пациенты старше 60 хуже переносят лечение, чем молодые.
Во-вторых, с возрастом накапливаются неблагоприятные воздействия на генотип, и вероятность мутаций с плохим прогнозом становится выше.
Биологические характеристики лейкозного клона
Точно так же, как и у детей, важнейший фактор прогноза – генотип клеток лейкемии. Цитогенетическое исследование и отнесение к группе благоприятного, неблагоприятного или промежуточного прогноза необходимо для правильного подбора схемы терапии. На практике в России такое исследование проводится не более 60% пациентов. Отсюда вытекает и третий фактор.
Адекватность химиотерапии
В зарубежных клинических рекомендациях этого фактора нет, к сожалению, он актуален исключительно для России. Даже правильно назначенные медикаменты могут оказаться менее эффективны, чем нужно, при уменьшении расчетных доз лекарства, несоблюдении интервалов между курсами и подобные «внешние» факторы.
Кроме этого, принадлежность к той или иной группе риска у взрослых определяет необходимость трансплантации костного мозга, и если цитогенетического исследования не было, отнести пациента к одной из трех групп невозможно.
Российские клинические рекомендации предлагают ориентироваться на клинические признаки как факторы неблагоприятного прогноза:
- возраст старше 40 лет;
- лейкоцитов крови > 100 х 109/л;
- наличие экстрамедуллярных поражений;
- после первого курса химиотерапии не наступила ремиссия;
- вторичный ОМЛ (возник после курса химиотерапии другого злокачественного новообразования);
Противопоказания
Полихимиотерапия – единственная возможность уничтожить клон лейкозных клеток. Но когда речь идет о взрослых пациентов с сопутствующими заболеваниями, приходится рассматривать противопоказания:
- инфаркт миокарда менее чем за месяц до начала лечения;
- застойная сердечная недостаточность;
- нарушения сердечного ритма, сопровождающиеся нестабильной гемодинамикой;
- почечная недостаточность кроме случаев, когда она вызвана лейкозным инфильтратом;
- острый вирусный гепатит;
- печеночная недостаточность кроме случаев, вызванных лейкозным инфильтратом;
- тяжелая пневмония, кроме вызванной лейкозными клетками;
- сепсис;
- кровотечение, угрожающее жизни;
- тяжелые патологии психики;
- истощение;
- сахарный диабет с показателем глюкозы крови >15 ммоль/л, не поддающийся компенсации;
- сопутствующая онкологическая патология с неконтролируемым течением.
- При этих состояниях агрессивная полихимиотерапия однозначно принесет больше вреда, чем пользы. Но если состояние удалось стабилизировать, то через неделю можно начать курс лечения.
Сама химиотерапия делится на 3 этапа:
- индукции ремиссии (1-2 курса);
- консолидации ремиссии (1-2 курса) – самый агрессивный и высокодозный этап;
- противорецидивное лечение.
Конкретные схемы и продолжительность курса различаются в зависимости от прогноза и предшествующих рецидивов.
После достижения ремиссии пациентам из группы высокого риска рекомендуется трансплантация костного мозга от совместимого донора. Как и при лечении детей, возможность использования этого метода ограничена доступностью донора. Несмотря на опасность трансплантации для возрастных пациентов (летальность 15-50%), рецидивов после нее практически не бывает.
Поддерживающая химиотерапия назначается в течение 1-2 лет после начала ремиссии (возможны варианты от 4 до 12 курсов). Количество и длительность курсов, а также интервалы между ними зависит от принадлежности больного к группе риска и реакции на лечение.
К сожалению, минимум у 60% взрослых пациентов рецидив наступает в течение 3 лет. Поэтому говорить о перспективах вылечиться довольно сложно.
Пятилетняя выживаемость колеблется от 4 до 46%. Прогноз зависит от генетических особенностей лейкоза, общего состояния больного и продолжительности ремиссии.
Источник: https://RosOnco.ru/gemoblastozy/ostryj-mieloblastnyj-lejkoz
Острый миелобластный лейкоз у взрослых прогноз жизни
ОМЛ у взрослых, как и у детей, характеризуется определенными симптомами и признаками. Клетки размножаются и изменяются с неконтролируемой скоростью, поэтому признаки заболевания появляются довольно быстро, и игнорировать их у человека никак не получится – слишком они яркие.
В числе симптомов данной патологии выделяют:
- Бледность кожных покровов – такой симптом нередко называют одним из первых и характерных, т.к. он сопровождает все патологии кроветворения.
- Признаки анемии.
- Бесконтрольные кровотечения, которые иногда трудно остановить.
- Появление субфебрильной температуры – она может колебаться в пределах 37,1-38 градусов, появление потливости во время ночного сна.
- Появление сыпи на коже – она представляет собой небольшие красные пятнышки, которые при этом не зудят.
- Появление одышки – причем она характерна даже для небольших физнагрузок.
- Появление чувства боли в костях, особенно активизирующееся во время ходьбы, но боль несильная, поэтому люди могут привыкнуть к ней.
- Появление не деснах припухлости, развитие кровоточивости и гингивита.
- Появление гематом – такие пятна красно-синего цвета могут появляться в любой части тела.
- Снижение иммунитета и частые инфекционные болезни.
- Резкая потеря веса.
Возраст пациента при этом не важен. У всех эти признаки при наличии данного заболевания будут появляться. Если интоксикация затронула головной мозг, появляются неврологические симптомы: головные боли, эпиактивность, рвота, ВЧД, нарушения слуха, зрения.
У детей могут проявляться следующие признаки:
- Ухудшение памяти;
- Апатия и нежелание играть;
- Боли в животе;
- Изменения походки.
Стоит понимать, что на разных стадиях заболевания при онкологии обычно бывают разные прогнозы. Кроме того, прогноз для жизни зависит от типа заболевания, возраста пациента, резистентности к химиотерапевтическим препаратам. При обнаружении заболевания на ранних этапах выживаемость близка к 90%.
Прогноз жизни при белокровии (остром миелоидном лейкозе), обнаруженном на 2-3 стадии, составляет 5 лет с учетом успешного лечения. Около 70% пациентов могут прожить данный срок, при этом в 35% случаев возникают рецидивы. У детей выживаемость выше примерно на 15-20%.
Прогноз у пациентов с промиелоцитарным лейкозом самый благоприятный. После постановки диагноза и проведенного лечения 70% взрослых живут 10-12 лет.
Точно сказать, что именно может запустить патологический процесс деформации в структуре ДНК стволовых клеток костного мозга, вследствие чего может начать развиваться острый миелобластный лейкоз, не может никто.
Этот факт, несмотря на многочисленные исследования, остаётся на сегодняшний день для науки неизвестным.
Но учёные, изучающие гематологические и онкологические заболевания, с точностью выявили несколько факторов риска, под влиянием которых острый лейкоз получает высокие шансы на зарождение и быстрое прогрессирование.
Основные причины, способствующие запуску патологического процесса, кроются в следующем:
- Длительное влияние радиационного или электромагнитного излучения. Под воздействием высокочастотных лучей в клеточных структурах происходят генные и хромосомные нарушения, что провоцирует начало мутации в клетках и дальнейшую их малигнизацию.
- Ряд вирусов, вызывающих развитие некоторых заболеваний. Чаще всего отмечается негативная роль вирусов герпеса, Эпштейна-Барра, гриппа. В общей же сложности бластомогенными является более сотни патогенных микроорганизмов. Они проникают в бластную кроветворную клетку и вызывают в ней мутацию, вследствие чего у человека начинает развиваться острый лейкоз того или иного типа.
- Воздействие некоторых групп лекарственных препаратов. Чаще всего провокаторами заболевания крови оказываются цитостатики, имеющие повышенную токсичность, или некоторые группы антибиотиков при бесконтрольном их употреблении.
Но основные причины, по мнению большинства учёных, кроются в наследственном факторе и генетической предрасположенности. Те люди, в семьях которых отмечались случаи онкологических поражений крови, имеют более высокие риски ощутить мучительные симптомы острого миелобластного лейкоза.
Опасность, которую представляет острый лейкоз, возникающий по причине деформации ДНК стволовых клеток миелобластов, заключается в смазанном, бессимптомном начальном этапе развития.
Большинство пациентов длительное время не беспокоят симптомы лёгкого недомогания, косвенно свидетельствующие о развитии миелобластного лейкоза. Иногда человек ощущает признаки нездоровья, но они настолько неспецифичны и сходны с банальной простудой, что не вызывают тревоги.
Больной не стремиться посетить врача, а старается самостоятельно купировать простудные симптомы, а острый миелобластный лейкоз в это время активно прогрессирует.
Переход заболевания в развёрнутую стадию, лечение при которой достаточно сложное, а шансы на выживание значительно сокращаются, сопровождается более выраженной симптоматикой.
Основные симптомы активно прогрессирующей болезни проявляются пятью основными для онкологии крови синдромами:
- Гиперпластический. Он связан с проникновением бластных клеток, незрелых предшественниц кровяных телец, в паренхиму печени и селезёнки, а также внутрибрюшинные лимфатические узлы, вызывая их увеличение. Также в этот период развития заболевания появляются специфичные симптомы механической желтухи.
- Геморрагический. Проявления этого синдрома разнообразны. Их вариабельность колеблется от появления одиночных подкожных пятнышек мелких размеров до обширных высыпаний и неожиданно появляющихся без механического воздействия синяков. Очень часто возникают обширные внутренние и носовые кровотечения.
- Анемический. Бледность кожи, вялость.
- Интоксикационный. Повышение температуры, снижение аппетита, тошнота, временами переходящая в рвоту, понос.
- Инфекционные. Они характеризуются учащением появления грибковых и бактериальных инфекций. Постоянными спутниками онкобольных становятся гнойные процессы, стоматит, пневмонии, бронхит. Отмечается развитие сепсиса.
Если появилась такая симптоматика, требуется экстренное посещение врача. Только своевременная медицинская помощь поможет сохранить человеку жизнь.
Все методы лечения миелобластного лейкоза направленны на достижение длительной ремиссии. Их подбирают для каждого пациента индивидуально, но основное место в них занимает химиотерапия. Лекарственная противоопухолевая терапия проводится в 2 этапа: индукционный, направленный на максимальное разрушение мутировавших клеток миелобластного типа и профилактический.
У большей части пациентов проведение индукционной терапии, для которой используют сильные цитостатики Цитарабин, Доксорубицин и Даунорубицин, в течение нескольких недель позволяет восстановить нормальную кроветворную функцию и купировать симптомы онкозаболевания.
Это даёт специалистам возможность говорить, что миелобластный лейкоз достиг условной клинической ремиссии.
Многим пациентам, исходя из медицинских показаний, назначают пересадку клеток костного мозга. Такая операция считается самым эффективным терапевтическим методом, но окончательное решение о её проведении принимается исключительно пациентом и его родственниками.
Облучение применяется редко в связи с наличием у этой процедуры большого количества негативных последствий, провоцируемых воздействием радиации на костный мозг. С осторожностью следует подходить и к народному лечению.
Оно допустимо только в качестве дополнительной терапии для купирования негативной симптоматики.
В связи с тем, что истинные факторы, провоцирующие развитие острого миелобластного лейкоза на сегодняшний день остаются загадкой, определённых профилактических мероприятий, способных предупредить возникновение онкопатоглогии крови, не существует.
Для того, чтобы минимизировать риски развития этого заболевания, необходимо придерживаться некоторых правил:
- ежегодно посещать врача для профилактического осмотра и сдавать анализы крови;
- вести здоровый образ жизни, ежедневно совершать длительные прогулки на свежем воздухе, в парках, лесополосе, у водоёмов;
- полностью отказаться от вредных привычек (употребление спиртного, курение, поздние обильные ужины) или свести их к минимуму;
- сбалансированно питаться. В пищевой рацион должны входить витамины и минеральные компоненты, необходимые для жизнедеятельности организма. Особое внимание следует уделить наличию в блюдах достаточного количества железа, фолиевой кислоты и витамина B12.
Помимо этого, людям, проживающим в экологически опасных местностях, следует задуматься о переезде, а работающим на вредных производствах о смене трудовой деятельности.
Но последние рекомендации не всегда выполнимы, поэтому при наличии этих неблагоприятных факторов необходимо особое внимание уделить укреплению иммунитета, а при появлении минимальных тревожных признаков обращаться за консультацией к опытному специалисту.
Источник: https://varikoznikam.ru/preparaty/ostryy-mieloblastnyy-leykoz-vzroslykh-prognoz-zhizni/
Острые миелоидные лейкозы у взрослых: клинические рекомендации ESMO (Европейского общества Клинической Онкологии) по диагностике, лечению и наблюдению
Acute myeloblastic leukemia in adult patient: ESMO Clinical recommendations for diagnosis, treatment and follow-up
M.Fey & M.Dreyling On behalf of the ESMO Guidelines Working Group Опубликовано: Annals of Oncology 19 (suppl 2): ii58-59, 2008
Эпидемиология
В странах Европы частота острых миелоидных лейкозов (ОМЛ) у взрослых составлят 5-8 случаев на 100 000 человек в год. Ежегодная смертность от этого заболевания достигает 4-6 случаев на 100 000.
Методы диагностики
Для установления диагноза необходимо проведение следующих исследований:
- морфология мазков периферической крови и костного мозга;
- цитохимия бластных клеток;
- иммунофенотип;
- цитогенетическое исследование;
- молекулярно-генетическое исследование.
Определение группы риска
Для определения группы риска важнейшее значение имеют следующие параметры:
- возраст пациента;
- число лейкоцитов на момент диагностики;
- данные кариотипа;
- выявленные молекулярные маркеры.
Выявление следующих хромосомных транслокаций определяет благоприятный прогноз: t(15;17) при остром промиелоцитарном лейкозе, t(8;21) при ОМЛ и t(16;16) при остром миеломонобластном лейкозе с эозинофилией. Кроме того, в группу благоприятного прогноза относят пациентов с выявленными мутациями генов нуклеофосмина (NPM) и C/EBPα [IIA].
Предшествующий миелодиспластический синдром или комплексные хромосомные аберрации, так же, как мутации гена FLT3, предполагают неблагоприятный прогноз заболевания.
Сопутствующие соматические заболевания, такие как ИБС или сахарный диабет, должны учитываться при планировании высокодозной полихимиотерапии. Пациенты старше 60 лет также более подвержены осложнениям лечения, и, кроме того, в этой группе чаще выявляются неблагоприятные хромосомные аномалии, что ассоциируется с неблагоприятным прогнозом.
Всем пациентам рекомендуется выполнение компьютерной томографии (КТ) грудной клетки для исключения инфекционных очагов, так же, как КТ или УЗИ брюшной полости для исследования размеров и возможных нарушений печени, почек и т.д. Кроме того, необходимо проведение электрокардио-графического и эхокардиографического исследования, особенно для пациентов с кардиологическим анамнезом [A].
В дополнение к клиническому и биохимическому анализам крови должно быть выполнено коагулологическое исследование, позволяющее выявить возможные нарушения свертывания (особенно при ОПЛ). Всем больным необходимо установление центрального венозного катетера.
HLA-типирование проводится пациентам и их потенциальным родственным донорам в тех случаях, если планируется проведение аллогенной трансплантации костного мозга (ТКМ) [A].
Тактика терапии
Лечение включает в себя курсы полихимиотерапии (ПХТ), проводящиеся с целью индукции и консолидации ремиссии. Оптимальной целью должно быть излечение больного.
Кандидаты для аллогенной ТКМ должны быть определены в ранние сроки: во время индукции ремиссии.
Пациентам с низким функциональным статусом и серьезными сопутствующими заболеваниями, которым невозможно проведение адекватной терапии, планируется паллиативное лечение.
Оптимальным является проведение терапии в рамках клинических исследований под руководством ведущих центров и в лечебных учреждениях широкого профиля, обладающих соответствующим оборудованием и квалифицированным персоналом. Необходимо тесное сотрудничество с отделениями трансплантации костного мозга, со специалистами по инфекционным болезням, адекватная трансфузиологическая служба и психо-онкологическая поддержка.
Индукционная химиотерапия
Полихимиотерпия должна начинаться после подтверждения диагноза. Больным с гиперлейкоцитозом до момента подтверждения диагноза проводятся лечебные лейкаферезы.
Индукционная полихимиотерапия в качестве обязательных составляющих включает антрациклины и цитозин-арабинозид [II,A]. Отсутствие ответа на два курса такой терапии считается рефрактерностью к лечению.
Терапия ОПЛ должна быть дополнена полностью транс-ретиноевой кислотой (АТРА) [II,A].
Гемопоэтические ростовые факторы могут быть использованы при проведении высокодозной ПХТ, но их роль в «праймировании» лейкемических клеток во время химиотерапевтического лечения пока не подтверждена.
Консолидационая полихимиотерапия
Пациенты, у которых достигнута ремиссия после индукции, должны пройти один или несколько консолидационных курсов ПХТ [II,A]. Пока нет единого мнения о «лучшей» стратегии постремиссионной терапии.
Больные из группы благоприятного прогноза могут проходить только полихимиотерапевтическое лечение, предпочтительно – включающее высокие дозы цитарабина.
Все другие пациенты при наличии совместимого сиблинга являются кандидатами для проведения аллогенной ТКМ в первой ремиссии [III,A].
В настоящее время применение низкодозных режимов кондиционирования позволяет проводить ТМ больным старше 40-45 лет.
Пациенты из группы высокого риска, не имеющие совместимого сиблинга, могут быть кандидатами для ТКМ от неродственного донора [III,A]. В случае несовместимости по KIR-рецепторам может рассматриваться гаплоидентичная трансплантация.
Пациенты, не достигнувшие полной ремиссии после первого курса индукции, считаются относящимися к группе высокого риска потери ремиссии, и должны рассматриваться как кандидаты для проведения алогенной трансплантации.
Роль высокодозной консолидационной терапии с поддержкой аутологичными гемопоэтическими стволовыми клетками при ОМЛ неоднозначна. Поддерживающая терапия АТРА успешна лишь при ОПЛ [III,A].
Терапия рефрактерных случаев и рецидивов
Пациенты во второй и последующих ремиссиях могут считаться кандидатами для алогенной ТКМ от совместимого неродственного донора. При рецидиве ОПЛ возможна индукция ремиссии триоксидом мышьяка (даже у пациентов, резистентных к АТРА) [III,B].
Оценка ответа на терапию
Ответ на индукционную терапию оценивается с помощью тщательного клинического обследования, последовательных анализов крови и костного мозга. Во время аплазии после индукционного курса возможно исследование пунктата костного мозга для определения раннего ответа или персистенции бластных клеток. Обычными критериями ответа при ОМЛ являются:
- нормальная клеточность костного мозга;
- уровень бластных клеток менее 5%;
- морфологически нормальный гемопоэз [B].
Наблюдение
Пациенты должны находиться под клиническим наблюдением и регулярно обследоваться для ранней диагностики возможного рецидива. Значение частых исследований костного мозга у больных в ремиссии без клинических и гематологических признаков рецидива до конца не определено.
Замечания
Уровень достоверности [I-V] и степень рекомендации [A-D] даны в квадратных скобках, как принято Американским Обществом Клинической Онкологии. Положения без соответствующих пометок считаются доказанными и утвержденными стандартами клинической практики по мнению экспертов ESMO.
Литература:
- Cheson BD, Casileth PA, Head DR et al. Report on the National Cancer Institute-sponsered workshop on definitions of diagnosis and response in acute myeloid leukemia. J Clin Oncol 1990; 8: 813-819
- Jabbour EJ, Estey E, Kantarjan HM. Adult acute leukemia. Mayo Clin Proc 2006; 81: 247-260
- Estey E, Dohner H. Acute myeloid leukemia. Lancet 2006; 368; 1894-1907
- Apelbaum FR, Pearce SF. Hematopoietic cell transplantation in first complete remission versus early relapse. Best Pract Res Clin Haematol 2006; 19: 333-339
- Stone RM, O’Donnel MR, Bassan R et al Acute myeloid leukemia. Crit Rev Oncol Hematol 2004; 50: 197-222
- Smith M, Barnett M, Bassan R et al. Acute myeloid leukemia. Crit Rev Oncol Hematol 2004; 50: 197-222
Источник: http://www.hematology.ru/oncohematology/acute_leukemias/publication/011.htm
Острый миелобластный лейкоз прогноз жизни у взрослых
Гематологические опухоли всегда вызывали большую настороженность. Невозможность визуально наблюдать злокачественное новообразование, зачастую – острое течение, характерная клиническая картина и очень сложная ранняя диагностика.
Оглавление:
Все эти характеристики можно смело отнести и к острому миелобластному лейкозу. Патологический процесс, протекающий в основном в костном мозге, развивается чаще всего у взрослого населения (85% из 100 заболевших). Наиболее уязвимый возрастлет. Детки болеют значительно реже (15% от общего количества всех пациентов).
О заболевании
Острый миелобластный лейкоз – это злокачественное видоизменение миелоидного кровяного ростка здоровой клетки крови. Новые, патологические клетки, с большой скоростью начинают размножаться, вытесняя здоровые.
И при этом они не могут выполнять все предназначенные им функции. Разносясь с током крови, измененные лейкоциты, попадают во все органы и системы человеческого организма. Происходит сбой в их нормальном функционировании.
Причины
Первопричина злокачественного процесса еще до конца не установлена. Существует ряд предрасполагающих факторов, которые очень сильно влияют на развитие патологического процесса. К ним можно отнести:
- хромосомные нарушения (очень часто данная патология развивается у пациентов, страдающих синдром Дауна);
- наследственность без генных мутаций: при выявлении острого миелобластного лейкоза в анамнезе у близких родственников, риск заболеваемости повышается в 5 раз. К группе риска относятся однояйцевые близнецы. Если заболел один, вероятность развития этого же патологического процесса у второго, составляет 25%;
- заболевания кроветворной системы;
- ионизирующее излучение (риск перерождения здоровых клеток в раковые повышается пропорционально возрастанию воздействия дозы радиации), патологическое состояние, вызванное радиоактивным излучением, чаще развивается в детском возрасте;
- контакт с токсическими веществами (толуол, бензол), заболевание может развиться спустя 1-5 лет после непосредственного контакта с химическими соединениями;
- прием лекарственных средств (в эту группу входят препараты, используемые при химиотерапии, содержащие мышьяк, Фенилбутазон, Хлорамфеникол), лекарственные острые миелобластные лейкозы составляют до 20% от общего количества случаев;
- курение (значительно ухудшает прогноз развития заболевания);
- влияние биологических факторов (воздействие онкогенных вирусов).
Несмотря на разнообразные факторы, которые могут спровоцировать развитие злокачественного процесса, итог будет один – изменение ДНК клеток крови. Повреждение затрагивает и механизм, отвечающий за естественную гибель клеток. Раковые клетки становятся «бессмертными».
Разделение по подвидам необходимо для выбора правильной тактики лечения.
Присутствуют характерные генетические изменения:
- транслокация между 8 и 21, 15 и 17, 9 и 11, 6 и 9, 1 и 22 хромосомами;
- изменения в 16 и в 3 хромосоме;
- мутация в генах: СЕВРА, NPM1.
Связанные с миелодисплазией:
- изменение кариотипа;
- сбалансированные и несбалансированные хромосомные аномалии.
- Вызванные предыдущим лечением (химиотерапия, лучевая терапия – происходит изменение на хромосомном уровне).
- Миелоидная саркома.
- Миелопролиферативные патологические процессы, связанные с синдромом Дауна.
- Бластная плазмацитоидная дендритноклеточная опухоль.
В медицинской литературе встречается франко-американская классификация острого миелобластного лейкоза:
- клетки дифференцированы минимально (5%);
- без созревания (20%);
- присутствуют признаки созревания (30%);
- промиелоцитарный (15%);
- миеломоноцитарный (25%);
- моноцитарный (10%);
- эритроидный (5%);
- базофильный (5%);
- мегакариоцитарный (10%).
Наиболее неблагоприятными по течению и исходу заболевания считаются острый миеломоноцитарный и острый моноцитарный лейкозы.
В этой статье описано, какие признаки лейкоза у детей видны по анализу крови?
Клиническая картина
По течению заболевания острый миелобластный лейкоз можно условно подразделить на несколько стадий:
- состояние предлейкоза (протекает бессимптомно);
- острая стадия патологического процесса;
- состояние полной или неполной ремиссии;
- наличие рецидивирующего течения;
- заключительная стадия.
После того, как произошла первая мутация на клеточном уровне и до развития классической картины острого миелобластного лейкоза протекает около 2 мес. За этот период, в костном мозге, происходит накопление патологически видоизмененных клеток.
Они полностью подавляют жизнедеятельность в норме функционирующих элементов кровеносной системы. В результате этого процесса появляется характерный симптомокомплекс.
Симптоматика
Первичной симптоматикой острого миелобластного лейкоза будут следующие проявления:
Возникает боль в области головы, в мышцах. Появляется повышенная потливость. Конечности отекают. Возникает видимая одутловатость лица и шеи.
Начинают кровоточить десна. Спонтанно возникают кровотечения из полости матки, желудка, кишечника, носа.
При любом (даже легком), физическом труде или физкультминутке – возникает чувство недостачи кислорода. Постоянно начинает кружиться голова и учащается сердцебиение.
Появляются неприятные ощущения в области суставов. Возникает тошнота, рвота. Может начаться диарея. Могут образовываться на коже специфические пятна красно-синего цвета (лейкемиды).
Сердце, печень, почки истощаются. Иногда в злокачественное течение заболевания вовлекается нервная система.
Необоснованное стремительное снижение общей массы тела является характерным признаком для всех раковых заболеваний.
Очень разнообразная клиническая картина и множественная симптоматика обусловлены тем, что все органы, которые имеют хорошее кровоснабжение, получают не здоровые клетки, а опухолевые.
Симптомы не появляются одновременно. Происходит их нарастание по мере прогрессирования болезни.
К этой статье приложены фото, на которых можно увидеть признаки меланомы.
Диагностика
Поставить правильный диагноз острый миелобластный лейкоз, опираясь на одни симптомы – невозможно. Необходимо провести ряд дополнительных методов диагностики:
Количество эритроцитов и ретикулоцитов снижено. Эозинофилы и базофилы отсутствуют. СОЭ значительно повышена.
Является наиболее достоверным для постановки правильного диагноза.
Так как на ранних стадиях патологического процесса, заболевание ничем себя не проявляет – заподозрить его можно при проведении профилактического осмотра со сдачей стандартного набора клинических анализов.
Лечение
На данном этапе развития медицинской науки существует две методики терапии миелобластного лейкоза: химиотерапия, носящая многокомпонентный характер и метод трансплантации костного мозга.
Химиотерапия проводится в три этапа:
- уменьшается количество бластных клеток до такого уровня, чтобы их нельзя было обнаружить лабораторными методами;
- ликвидация оставшихся лейкозных клеток;
- повторение первого этапа.
На всем протяжении химиотерапии проводится дополнительная терапия оральными цитостатиками. Длительность лечения составляет до 2 лет.
Дополнительное лечение включает в себя:
- переливание препаратов крови;
- дезинтоксикационные препараты;
- антибиотикотерапия;
- облучение области головного мозга с целью профилактики развития неврологических нарушений;
- эндолюмбальное введение цитостатиков;
- противогрибковые и противовирусные препараты;
- витиминотерапия.
Трансплантацию костного мозга необходимо проводить во время первой ремиссии. А, если произошел рецидив заболевания – это является единственно правильным выбором лечебной тактики.
Лучевая терапия используется намного реже при этом злокачественном новообразовании.
При вхождении пациента в состояние стадии полноценной ремиссии у него должна наблюдаться следующая симптоматика:
- нет явных проявлений развития патологического процесса;
- в крови не больше 5% бластных клеток и в норме остальные кроветворные клетки;
- бластные клетки отсутствуют в периферической кроветворной системе;
- нет злокачественных новообразований выходящих за пределы основной локализации злокачественного новообразования.
Для тех больных, которым противопоказана эта кардинальная методика лечения, необходима иммуномодулирующая и поддерживающая терапия.
Прогноз
Рак крови – это грозное и опасное заболевание. Но и его, возможно, излечить, если ввести пациента в состояние стойкой ремиссии.
Очень сильно прогноз благоприятного исхода зависит от возраста и ответной реакции организма на проводимое лечение.
Выживаемость у детей составляет от 60% до 85%. У взрослого населения: от 20% до 40%.
Острый миелобластный лейкоз очень трудно выявить на ранних стадиях. Он тяжело поддается терапии. Поэтому, необходимо при первых неясных симптомах обращаться к врачу. Раннее выявление заболевания – является залогом жизни или длительной ремиссии.
В заключение рекомендуем посмотреть видео с познавательной лекцией о составе и функциях крови:
Источник: http://ifc-rt.ru/ostryj-mieloblastnyj-lejkoz-prognoz-zhizni-u/
Острый промиелоцитарный лейкоз у взрослых: клинические рекомендации, протоколы лечения
Острые промиелоцитарные лейкозы относят к острым миелоидным лейкозов, которые представляют собой гетерогенную группу опухолевых заболеваний системы крови, возникающих в результате мутации в стволовой клетке-предшественнице гемопоэза, в результате чего происходит блок дифференцировки и начинается неконтролируемая пролиферация недифференцируемых опухолевых кроветворных клеток, вытесняющих нормальные.
ОПЛ представляет собой четко очерченную нозологическую форму в рамках острых миелоидных лейкозов с настолько характерными клинико-лабораторными признаками (типичная морфология опухолевых клеток, тяжелый геморрагический синдром, гематомный тип кровоточивости, избыточно активированный фибринолиз, ДВС-синдром, обычно лейкопения), что диагноз порой можно установить, основываясь лишь на клинических проявлениях. Тем не менее, именно этот вариант ОМЛ требует жесткой верификации диагноза молекулярно-генетическими методами.
Это обусловлено тем, что именно с острым промиелоцитарным лейкозом связано одно из самых принципиальных открытий в области биологии лейкозов: обнаружен феномен дифференцировки бластных клеток промиелоцитарного лейкоза под воздействием дериватов ретиноевой кислоты — 13-цис-ретиноевой, полностью транс-ретиноевой (ATRA), 9-цис-ретиноевой кислоты. Именно ATRA стала первым, так называемым, «таргетным» препаратом. Применение полностью транс-ретиноевой кислоты (ATRA; третиноин) революционным образом изменило исходы терапии ОПЛ.
После появления ATRA, арсенал патогенетических эффективных методов терапии был расширен за счет триоксида мышьяка (АТО), являющегося, вероятнее всего, одним из наиболее активных биологических средств в лечении ОПЛ. И уже не вызывает сомнения тот факт, что острые промиелоцитарные лейкозы могут быть излечены даже без применения цитостатических препаратов.
Лечение ОПЛ освещается в текстах национальных рекомендаций из США и Великобритании, посвящённых терапии ОМЛ, которые включают лишь некоторые конкретные пункты, касающиеся терапии ОПЛ.
В 2009 году европейская организация LeukemiaNet, объединив международных экспертов, разработала европейские рекомендации по лечению ОПЛ, основанные как на результатах уже проведенных исследований, так и на мнениях ведущих экспертов.
Российская исследовательская группа по лечению острых лейкозов с 1997 года, когда ATRA (полностью трансретиноевая кислота) стала основной частью программного лечения ОПЛ, провела несколько проспективных многоцентровых и одноцентровых исследований по лечению ОПЛ.
Опыт российских гематологов и международные публикации стали основой представляемых Национальных рекомендаций по лечению ОПЛ взрослых.
Публикация национальных рекомендаций по лечению такого «коварного» варианта острых миелоидных лейкозов необходима по разным причинам.
Во-первых, ОПЛ является редким заболеванием, и большинству пациентов терапия осуществляется в учреждениях с ограниченным опытом лечения этого варианта острых лейкозов.
Во-вторых, прекрасные долгосрочные результаты, представленные в литературе, могут породить ложное чувство безопасности и удовлетворенности, что может привести к недооценке важности некоторых аспектов терапии ОПЛ.
В- третьих, на некоторые вопросы, связанные с лечениемОПЛ, до сих пор не найдены однозначные ответы, они лишены большой доказательной базы, и следовательно, могут повышать риск принятия ошибочных решений, которые, хотя и соответствуют общей стратегии лечения других видов ОМЛ, неприемлемы при терапии ОПЛ.
Источник: https://bz.medvestnik.ru/nosology/Ostryi-promielocitarnyi-leikoz-u-vzroslyh.html